
книги / Порошковое материаловедение. Основы теоретического материаловедения
.pdf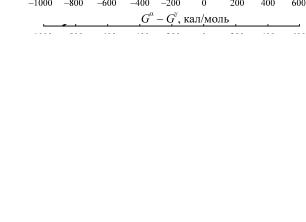
Электронную энтропию, оказывающую влияние на фазовые превращения, можно разделить на две составляющие, одна из которых обусловлена «вырождением» состояний, не связанных с ориентацией спинов, а другая – неопределенностью ориентации спинов. Роль электронных спинов в фазовых превращениях рассмотрим на примере аллотропических форм чистого железа. Разность между свободными энергиями α- и γ-модификаций чистого железа, разложенная на две состав-
ляющие, приведена на рис. 42. Первая получена простой экстраполяцией низкотемпературных данных. Эта составляющая была бы единственной, если бы в α -фазе не происходила разориентировка магнитных моментов атомов железа. Но появля-
ется вторая компонента Gα Gγ магн , которая как раз и обусловлена такой разориентацией. Таким образом, разориентация не только вызывает превращение α -фазы, но и обусловливает при еще более высоких температурах протекание этого процесса в обратном направлении, что приводит опять к образованию ОЦК-фазы.
Рис. 42. Разложение разности между свободными энергиями α- и γ -железа на магнитные составляющие
61
Знание функции Gα Gγ (см. рис. 42) и работы переноса моля растворенного вещества из чистой α -фазы в чистую γ-фазу Gα γ позволяет рассчитать железную часть диа-
граммы равновесия бинарных сплавов железа. Если Gα γ не зависит от температуры, то двойные диаграммы можно построить по рис. 42. Так, элемент с положительной величиной
Gα γ будет замыкать γ-область, и наоборот, с отрицательной
величиной Gα γ будет расширять γ-область. Поскольку спиновая энтропия играет такую роль в превращениях железа, то
можно предположить, что температурная зависимость Gα γ будет определяться, по крайней мере в первом приближении, влиянием ближнего порядка в расположении магнитных спинов.
Таким образом, стремление изолированной системы к максимуму энтропии и изменение энтропии при различных превращениях определяется в конечном счете степенью разупорядочения системы. Система переходит от менее вероятных состояний к более вероятным, т.е. таким, которые осуществляются наибольшим числом способов. То есть чем более разупорядочена система, тем большим числом способов осуществляется ее макроскопическое состояние и тем выше должна быть энтропия. Однако при установлении направления процесса превращения необходимо учитывать не только изменение энтропии, но и тепловой эффект, отражающий изменение внутренней энергии, так как в неизолированных системах условием равновесия является не максимум энтропии, а минимум свободной энергии G. При равновесной температуре для реакции Gα Gβ α β. Для любого фазового превращения
свободная энергия G является непрерывной функцией. Установлено, что
62
G |
S. |
(23) |
||
|
|
|||
|
T p |
|
|
|
|
G |
V. |
(24) |
|
|
|
|||
|
P T |
|
|
|
(G /T ) |
H. |
(25) |
||
(1/T ) |
||||
|
|
|||
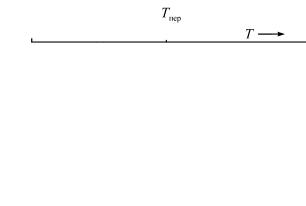
Если переход характеризуется прерывистостью в какойлибо из первых производных свободной энергии, его называют переходом первого рода (порядка). Такими переходами являются агрегатные и аллотропические превращения.
Все они обнаруживают прерывность в S, V , H при температурах перехода. На рис. 43 приведен пример изменения G от температуры T для перехода первого рода (порядка). Очевидно, что если первая производная обнаруживает прерывность, то все производные более высокого порядка прерывны.
Рис. 43. Фазовый переход первого рода (порядка)
63
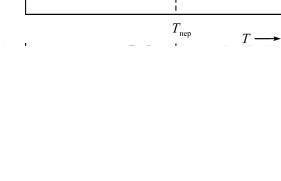
В то же время для ряда превращений наблюдается непрерывность первых производных свободной энергии. В этих случаях функции энтропии и энтальпии также непрерывны.
Если такое превращение характеризуется прерывностью вторых производных функций свободной энергии, то его называют переходом второго рода (порядка). Примерами такого перехода являются превращения порядок-беспорядок, переход из ферромагнитного состояния в парамагнитное, переход в сверхпроводящее состояние и т.д. Изменения свободной энергии для α- и β-фаз при переходе второго рода (порядка) приведены на
рис. 44.
Рис. 44. Фазовый переход второго рода (порядка)
Изменение свободной энергии определяется только начальным и конечным состоянием системы и не зависит от характера процесса.
Рассмотренное выше относится к однокомпонентным фазам, а при появлении второго компонента, т.е. при переходе к раствору, появляется новая термодинамическая переменная – концентрация в идеальном растворе, в котором либо нет взаимодействия компонентов, либо взаимодействие всех компонентов приблизительно одинаково, все свойства компонентов выражаются через их концентрацию. В реальных растворах по-
64
является новая термодинамическая переменная – активность компонента в растворе аi.
Если раствор приближается к идеальному, то активность становится равной концентрации, тогда в общем случае ai ci .
Физически активность характеризует стремление компонента покинуть фазу (раствор), и, следовательно, взаимодействие компонентов в растворе и степень его отклонения от идеального. Коэффициент активности γi ai / Ni , для идеального рас-
твора γi 1. Если γi 1, говорят о положительных отклонени-
ях от идеальности: компонент менее охотно растворяется, взаимодействие носит характер отталкивания. Такие отклонения должны приводить к ограниченной растворимости или к полному ее отсутствию. При γi 1 компонент охотно входит
в раствор, взаимодействие носит характер притяжения. Сплавы могут содержать различные фазы, имеющие опре-
деленный химический состав и отделенные от других фаз поверхностью раздела.
В сплавах могут существовать твердые растворы, промежуточные фазы и химические соединения.
3.1. Твердые растворы
Твердые растворы образуются в том случае, когда атомы различных элементов, смешиваясь, способны образовывать общую кристаллическую решетку. Установлено, что все металлы и соединения в той или иной степени обнаруживают некоторую растворимость в твердом состоянии. Твердые растворы как фазы переменного состава могут быть образованы любым числом компонентов. Если компоненты могут замещать друг друга в кристаллической решетке в любых соотношениях, то в этом случае образуется непрерывный ряд твердых растворов. Если на диаграмме состояния область твердого раствора не выходит за пределы той части диаграммы, которая примы-
65

|
|
кает к чистым компонентам, то |
|
|
|
такие твердые растворы назы- |
|
|
|
ваются ограниченными. Раство- |
|
|
|
ры эти имеют ту же структуру, |
|
а |
б |
что и компоненты, которые по- |
|
служили основой их образова- |
|||
|
|
ния. Образуются различные ти- |
|
|
|
пы твердых растворов (рис. 45). |
|
|
|
Если при образовании твер- |
|
|
|
дых растворов атомы компонен- |
|
в |
г |
тов, принимающих участие в об- |
|
разовании последних, сущест- |
|||
Рис. 45. Схематическое изобра- |
|||
венно отличаются друг от друга, |
|||
жение различных типов твер- |
то возможно внедрение атомов |
||
дых растворов: а – замещения |
|||
с беспорядочным |
расположе- |
одного типа в межузлия кри- |
|
нием атомов; б – замещения |
сталлической решетки, образо- |
||
с упорядоченным |
расположе- |
ванной атомами другого типа. |
|
нием атомов; в – |
внедрения |
Такие типы твердых растворов |
|
с беспорядочным |
расположе- |
получили название твердых рас- |
|
нием атомов; г – образование |
|||
скоплений одноименных ато- |
творов внедрения. |
||
мов в твердом растворе |
Образование подобных рас- |
||
творов имеет место при растворении в металлах неметаллических элементов, таких как бор, кислород, азот, углерод и т.п. При сплавлении могут образовываться растворы замещения. При этом атомы растворяемого вещества занимают места в узлах кристаллической решетки растворителя, образуя общую кристаллическую решетку.
Твердые растворы вычитания (растворы с дефектной решеткой) образуются лишь на основе химических соединений. В таких твердых растворах часть позиций атомов (ионов) второго недостаточного компонента оказываются пустыми. Например, в кристалле вюстита, являющемся твердым раствором кислорода в FeO, все позиции решетки, в которых должны на-
66
ходиться кислородные ионы, заполнены; часть позиций, в которых должны расположиться ионы железа, вакантны.
Большое распространение твердые растворы получили в металлических системах, образующих сплавы. Связано это с тем, что большинство растворов построено по металлическому типу, предусматривающему соединение не химическими связями, а притяжением к свободным электронам. Связи этого типа малочувствительны к соблюдению точного количественного соотношения атомов, участвующих в образовании раствора, и к их точному расположению в атомных местах.
Некоторые сплавы при определенном составе могут существовать как в виде упорядоченных (при более низких температурах), так и в виде неупорядоченных (при более высоких температурах) твердых растворов. Переход упорядоченного состояния в неупорядоченное и обратно может быть фазовым переходом как первого, так и второго рода (подобно ферромагнитным превращениям в точке Кюри или переходу обычного гелия в сверхтекучий). В этом случае он носит «кооперативный» характер.
Средняя энергия, необходимая для перехода в неупорядоченное состояние, уменьшается по мере снижения степени упорядоченности. Другими словами, чем меньше «порядка», тем легче происходит его дальнейшее нарушение. Это означает, что при увеличении температуры порядок уменьшается постепенно до нуля, причем если в узком интервале температур вблизи Tc наблюдается скачок степени упорядоченности, то
мы имеем дело с фазовым переходом І рода. Во многих случаях (например, в сплавах CuAu, Cu3Au ) так и бывает, и переход
от порядка к беспорядку сопровождается поглощением энергии.
Процесс упорядочения наблюдается при соблюдении некоторых условий, например, для сплава медь – золото, содержащего 76 % Cu и отвечающего формуле Cu3Au, упорядоче-
67
ние происходит при медленном охлаждении с 250–300 °С. При этом меняются свойства – сильно возрастают проводимость и температурный коэффициент электросопротивления, обычно увеличивается сопротивление пластической деформации и уменьшается пластичность, изменяются электрохимические свойства, возрастает теплоемкость. Структурных изменений под микроскопом чаще всего не наблюдается, кристаллическая решетка сохраняется, однако на рентгенограммах появляются сверхструктурные линии слабой интенсивности (упорядоченные растворы иногда называют сверхструктурами), они отвечают упорядоченному расположению атомов. Некоторые типы сверхструктур приведены на рис. 46.
В сплаве Fe3Al после медленного охлаждения или низко-
температурного отжига также обнаруживаются сверхструктурные линии. Атомы алюминия находятся на максимально возможном удалении друг от друга. Нет ни одной пары атомов алюминия, которые являлись бы соседями (подобно атомам золота в Cu3Au, где ближайшие соседи находятся во второй ко-
ординационной сфере).
Упорядочение является, по-видимому, следствием двух факторов: потенциального и кинетического. В некоторых фазах посторонним атомам энергетически невыгодно располагаться в непосредственной близости от атомов основы, что приводит, как уже говорилось, к созданию ближнего порядка. При этом уменьшаются искажения и понижается свободная энергия. В то же время тепловое движение атомов способствует их хаотическому распределению. Критическая температура упорядочения Tc является результатом взаимодействия этих
факторов.
Как правило, процессу упорядочения должны благоприятствовать следующие условия: достаточно медленное охлаждение (для реализации процессов диффузии), достаточная растворимость (при которой возможно установление стехиомет-
68
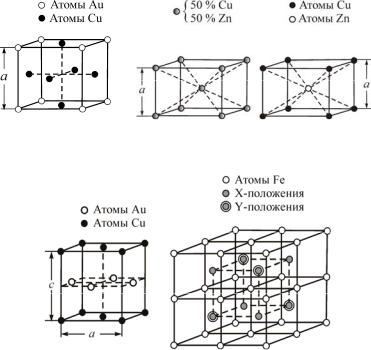
аб
вг
Рис. 46. Различные типы упорядоченных сверхструктур: а – упорядоченная кубическая сверхструктура Cu3Au ; б – разупорядоченная
и упорядоченная структуры β -латуни; в – тетрагональная сверхструктура CuAu; г – структуры Fe3Al и FeAl (атомы алюминия занимают x положения в случаеFe3Al , а в случае Fe3Al – положения x и y; светлые кружочки – атомы железа)
рического соотношения атомов) и благоприятный объемный фактор (если разница в размерах обоих атомов уменьшается, то уменьшаются и напряжения); следовательно, уменьшается различие в энергии обоих состояний и Tc понижается. Требуется
некоторая оптимальная величина d. В системах CuAu
69
и FeAl объемный фактор на грани благоприятного dCu =
= 0,254 нм (2,54 Ǻ) и dAu = 0, 288 нм (2,88 Ǻ); dFe = 0,25 нм (2,5 Ǻ) и dAl = 0,28 нм (2,8 Ǻ).
Поскольку процесс упорядочения требует диффузионного перераспределения атомов, образование упорядоченного раствора зависит от соотношения температуры плавления Tпл,
критической температуры упорядочения Tc и критической температуры диффузии Tд (температура, ниже которой ско-
рость диффузии столь мала, что даже при самом медленном охлаждении сплава упорядочение не достигается). В случае Тс Тпл из жидкости выделяются кристаллы в полностью упо-
рядоченном состоянии, такие сплавы напоминают металлические соединения. Если Тпл Tc Tд, то упорядоченное состоя-
ние возникает уже после затвердевания по достижении Tc , когда скорость диффузии еще достаточно высока, и, наконец, при Тс Тд упорядоченное расположение атомов невозможно, как
бы ни была мала скорость охлаждения сплава, так как скорость диффузии незначительна. Такие сплавы являются полностью разупорядоченными. Например, сплав Cu3Sb образуется упо-
рядоченным из жидкой фазы, сплавы Cu3Au и CuAu – из твердой, а AgAu является примером неупорядоченного рас-
твора.
Учитывая, что ближний порядок сохраняется выше точки Кюри, можно рассмотреть общую схему превращения ближнего порядка в дальний. При высокой температуре непрерывно создаются и разрушаются небольшие упорядоченные группировки атомов. С понижением температуры ближний порядок развивается все больше и при достижении критической температуры области упорядочения приобретают достаточные размеры. На основании рентгеновского исследования сверхструк-
70
