
книги / Химия воды и основы очистки природных и сточных вод физико-химическими методами
..pdfЧисленные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности.
Опыт 6. Определение содержания нефтепродуктов в сточной воде
Приборы и оборудование:
1. ИК-спектрофотометр.
2. Хроматографическая колонка диаметром 1 см, высотой
20 см – 4 шт.
3. Экстрактор ПЭ-8000 с делительной воронкой.
Реактивы и материалы:
1.Окись алюминия Аl2O3 ч.д.а., безводная (прокаленная при 600 оС в течение 4 часов).
2.Четыреххлористый углерод ССl4 х.ч. по ГОСТ 20288-74.
3.Сульфат натрия Na2SO4 х.ч. безводный, прокаленный при
600 оС.
Подготовка к анализу Калибровка концентратомера КН – 2м
Для калибровки КН-2м используют стандартный раствор углеводородов в четыреххлористом углероде (концентрация нефтепродуктов 50 мг/см3).
Ампулу вскрывают, раствор из ампулы количественно переносят в мерную колбу объемом 50 см3, затем ампулу три раза промывают четыреххлористым углеродом порциями по 3–5 мл, сливая в мерную колбу, и потом доводят объем раствора четыреххлористым углеродом до метки. Получают стандартный раствор с концентрацией нефтепродуктов 1000 мг/дм3.
Рабочий раствор нефтепродуктов готовят разбавлением основного раствора НП. Для этого в мерную колбу объемом 50 см3 вносят пипеткой 5 мл полученного стандартного раствора и доводят объем раствора четыреххлористым углеродом до метки. Получают раствор с концентрацией 100 мг/ дм3. Раствор перемешивают и хранят в холодильнике.
21
Порядок проведения калибровки прибора
1.Налить в кювету чистый четыреххлористый углерод и установить нулевое значение.
2.Заполнить кювету приготовленным раствором нефтепродуктов с концентрацией 100 мг/ дм3 и установить показатель 100.
3.При необходимости повторить измерение.
Ход определения
Пробу воды объемом 0,5 л помещают в делительную воронку, приливают 10 мл четыреххлористого углерода и содержимое перемешивают в течение 10 мин мешалкой 1500 об/мин. После расслоения эмульсии нижний слой сливают в стаканчик объемом 50 мл. Экстракт сушат безводным сульфатом натрия в течение 10 мин (2 г Na2SO4 на 10 мл экстракта), добавляя его порциями. Затем экстракт осторожно сливают в цилиндр емкостью 50 мл с притертой пробкой, стенки колбы и сульфата натрия ополаскивают двумя-тремя порциями (по 2 мл каждая) четыреххлористого углерода, которые присоединяют к экстракту. Экстракт тщательно перемешивают.
Одновременно готовят хроматографическую колонку. В нижнюю часть вымытой и высушенной колонки помещают кусочек стекловолокна и затем в колонку засыпают 3 г оксида алюминия. Стеклянную вату кладут также поверх слоя окиси алюминия для предотвращения взмучивания. Оксид алюминия в колонке используют один раз.
В подготовленную колонку наливают 3 мл четыреххлористого углерода для смачивания. Как только четыреххлористый углерод впитается в оксид алюминия, выливают экстракт тремя порциями (необходимо следить, чтобы уровень жидкости не опускался ниже слоя Аl2O3) и пропускают его через колонку со скоростью 0,3 мл/мин. Первые 3 мл экстракта отбрасывают, а оставшуюся часть собирают в мерный цилиндр объемом 10–25 см3.
Фиксируют объем элюата и измеряют концентрацию нефтепродуктов на приборе КН-2м.
Определение массовой концентрации нефтепродуктов в холостой пробе выполняют одновременно с анализом основной пробы.
22
Концентрацию нефтепродуктов определяют по формуле
Сх |
Сизм Vэк K |
, |
(1.8) |
|
V |
||||
|
|
|
где Сх – концентрация нефтепродуктов, мг/л; Сизм – концентрация нефтепродуктов, мг/л (показания прибора); Vэк – объем четыреххлористого углерода для экстракции – 10 мл; V – объем анализируемой сточной воды, мл; K – коэффициент разбавления.
Из результатов анализа вычитают данные, полученные при анализе холостой пробы.
2. ПРИМЕНЕНИЕ МЕТОДА КОАГУЛЯЦИИ ДЛЯ ОЧИСТКИ СТОЧНЫХ ВОД
Теоретические аспекты коагуляционной очистки сточных вод
Для очистки сточных вод, содержащих коллоидные примеси, высокомолекулярные органические соединения, эмульгированные, тонкодисперсные частицы, широко используются методы коагуля-
ции и флокуляции.
Под коагуляцией понимается процесс укрупнения и объединения в агрегаты коллоидных и взвешенных частиц дисперсной системы под действием введенных в сточную воду реагентов – коагулянтов. В результате коагуляции происходит хлопьеобразование и осаждение примесей.
Коллоидные частицы – мицеллы (размер частиц 10–100 нм) характеризуются в водных растворах высокой агрегативной устойчивостью, что объясняется их строением.
На поверхности твердых частиц коллоидных растворов способны адсорбироваться ионы – потенциалопределяющие ионы. Заряд ионов компенсируется противоионами (ионами противоположного знака), в результате на поверхности частицы образуется двойной электрический слой.
23
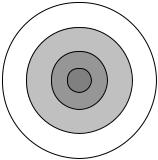
Слой противоинов состоит из двух частей: адсорбционного, непосредственно связанного с потенциалопределяющими ионами, и диффузного слоя, толщина которого зависит от свойств и состава системы. В целом мицелла – электронейтральна (рис. 2.1), что определяет ее стабильность. Разность потенциалов между потенциалопределяющими ионами и противоионами называется потенциалом двойного электрического слоя ДЭС – φ-потенциалом.
IV
III
II I
.
Рис. 2.1. Строение мицеллы: I – ядро мицеллы;
II– адсорбционный слой; (I–II – гранула); III – диффузионный слой; IV – гидратная оболочка
При движении мицелл в растворе или в электрическом поле часть противоионов диффузного слоя остается в дисперсионной среде (воде) и гранула приобретает заряд, соответствующий заряду потенциалопределяющих ионов. Разность потенциалов между адсорбционным и диффузным слоями противоионов называется электрокинетическим ζ-потенциалом. Чем выше его заряд, тем устойчивее система. Строение мицеллы описывают формулой.
Для примера рассмотрим дисперсную систему: водный раствор – гуминовая кислота, определяющая цветность природных вод.
В этой системе потенциалопределяющим ионом выступает анион гуминовой кислоты (Gum–), противоином – ион водорода.
Ядро мицеллы
m(GumH ) nGum
24

Формула мицеллы |
|
|
|
|
|
m(GumH ) nGum |
|
n x H |
|
xH |
|
|
|
||||
|
|
|
|
|
|
Одним из способов дестабилизации коллоидной системы является введение в систему электролитов – ионов, заряд которых противоположен заряду потенциалопределяющего иона мицеллы. Введение ионов приводит к сжатию двойного электрического слоя, нейтрализационной коагуляции.
Впрактике очистки сточных вод используется гетерокоагуляция, т.е. взаимная коагуляция двух дисперсных систем, потенциалоопределяющие ионы которых имеют противоположный заряд.
Вкачестве коагулянтов обычно используют растворы солей, способные подвергаться гидролизу и образовывать коллоидные сис-
темы: сульфат алюминия (АL2(SO4)3), оксихлорид алюминия, сульфат железа (II) или (III), хлорид железа (III), а также карбонат кальция, гидроксид магния, фосфат кальция и др.
Например, гидролиз сульфата алюминия протекает по следующим стадиям c образованиемосновных солей игидроксида алюминия:
A13+ + H2O = A1(OH)2+ + H+
Аl(ОH)2+ + Н2O = Аl(ОH)2+ + H+
Al(OH)2+ + H2O = Al(OH)з + H+
Alз+ + 3H2О = Al(OH)з + 3H+
Строение мицеллы гидроксида алюминия
Al(OH)3 |
m |
nAl3 |
3/2(n x)SO42 | 3/2xSO42 |
|
|
|
При введении сульфата алюминия в раствор, содержащий гуминовую кислоту, будет происходить взаимная нейтрализация и коагуляциях этих систем.
Рассмотрим факторы, влияющие на процесс коагуляции.
рН. Гидролиз коагулянтов приводит к снижению рН среды, накоплению H+ и снижению степени гидролиза. Для усиления гидролиза необходимо подщелачивание воды.
25
Если концентрация ионов ОН–, HCO3 , содержащихся в воде,
недостаточна для полного гидролиза коагулянта, щелочность воды повышают введением в воду гашеной извести (гидроксида кальция Са(ОН)2), гидроксида натрия или раствора соды (Na2CO3).
Количество добавляемого щелочного реагента можно определить по эмпирической формуле
|
1 |
|
|
|
|
Дщ Эщ |
|
Дк Щ 1 |
, |
(2.1) |
|
Эк |
|||||
|
|
|
|
где Дщ – количество добавляемого щелочного реагента, мг/дм3; Эщ – молярная масса эквивалента добавляемого щелочного реагента, ммоль-экв/дм3; Дк – максимальная доза коагулянта, мг/дм3; Эк – молярная масса эквивалента коагулянта, ммоль-экв/дм3; Щ – щелочность воды, ммоль-экв/дм3.
Величина резервной щелочности, которая остается после обработки воды коагулянтом, должна составлять не менее 1 мг-экв/л.
Значения оптимальных значений рН при очистке сточных вод коагуляцией при использовании различных коагулянтов:
Al2(SO4)3 |
– 4,5–7 |
СаСО3 |
– 9–11,5 |
FеSO4 |
– 8,5–10,5 |
Са3(РО4)2 |
– 10–11 |
Fе2(SO4)3 |
– 4–6 и 8–10 |
СаSO4 |
– 4–10 |
Доза коагулянта. Доза коагулянта (Дк) – количество коагулянта в единице объема обрабатываемой воды, мг/л; г/м3. Оптимальной считается доза коагулянта, когда при обработке сточной воды образуются крупные хлопья и достигается максимальное ее осветление через 15–20 мин. Оптимальная доза коагулянта подбирается экспериментально пробным коагулированием воды.
На основе полученных данных строится коагуляционная кривая – зависимость цветности воды или другого показателя (мутность, ХПК) от дозы коагулянта.
График коагуляционной кривой приведен на рис. 2.2.
Кривую можно разбить на три зоны. В первой зоне практически не наблюдается осветления и обесцвечивания воды, далее наблюдается процесс быстрой коагуляции и осветления. Границу между пер-
26
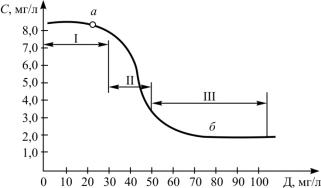
вой и второй зонами называют порогом коагуляции, где наименьшая концентрация реагента, при которой начинается коагуляция. Порог коагуляции зависит от свойств обрабатываемой воды, заряда иона электролита, используемого в качестве коагулянта, и др. В третьей зоне увеличение дозы коагулянта не дает значительного повышения эффективности процесса.
Рис. 2.2. Коагуляционная кривая:
а – порог коагуляции; б – оптимальная доза
Граница между второй и третьей зонами является оптимальной дозой.
Температура. С ростом температуры уменьшается степень гидратации частиц и увеличивается вероятность столкновения частиц, возрастает скорость кристаллизации коагулянта и уменьшается продолжительность инкубационного периода.
Перемешивание. В результате интенсивного механического перемешивания происходит нарушение адсорбционного баланса у поверхностичастиц, снижениеих агрегативной устойчивости икоагуляция.
Состав сточных вод
Неорганические вещества, имеющие общий ион с коагулянтом, ускоряют процесс коагуляции и хлопьеобразования.
По степени влияния на процесс коагуляции анионы могут быть расположены в ряд: Cl НСО3 SO24 . При коагулировании примесей воды с солесодержанием до100 мг/л процесс протекает мед-
27
ленно. Добавка SO24 ускоряет его и значительно расширяет зону
оптимальных значений рН в сторону понижения.
Органические вещества, адсорбируясь на растущих хлопьях коагулянта, образуют пленки, тормозящие агрегацию.
Увеличение концентрации коллоидных и мелкодисперсных при-
месей увеличивает скорость коагуляции.
При коагуляционной очистке сточных вод одновременно протекают процессы соосаждения, сорбции и ионного обмена. В результате из воды могут удаляться органические вещества, поверхностноактивные вещества (ПАВ), ионы тяжелых металлов.
Для ускорения процесса коагулирования, хлопьеобразования и повышения его эффективности используют флокулянты, представляющие собой высокомолекулярные вещества – полиэлектролиты. Механизм действия флокулянтов заключается в их адсорбции одновременно на нескольких частицах, что приводит к увеличению их размера и скорости осаждения.
В качестве флокулянтов для очистки природных и сточных вод от окрашенных и коллоидных частиц используют анионные полиэлектролиты, содержащие группы –СООН, –SO3Н, –ОН (активная кремниевая кислота, полиакрилат натрия, лигносульфонаты, полиакриламид, высокомолекулярные соединения на основе полиакриламида и др.), катионные полиэлектролиты – полимеры, содержащие группы –NН2, –NН (полиэтиленимин, сополимеры винилпиридина), амфотерные, содержащие катионныеианионныегруппы(гидролизованныйполиакриламид).
ЛАБОРАТОРНАЯ РАБОТА № 2 Определение дозы коагулянта, необходимой для осветления и очистки сточной воды
Цель работы – определение доз коагулянта, необходимых для удаления из исследуемой воды взвешенных и коллоидных загрязнений, вызывающих ее мутность и цветность. Определение влияния рН очищаемой сточной воды на эффективность процесса коагуляции.
Приборы и оборудование:
1.Мерные цилиндры емкостью 0,5 л.
2.Пипетка, 1 мл, 5 мл, 10 мл.
3.Фотоэлектроколориметр.
4.Кюветы с толщиной слоя 50 мм.
28
Реактивы:
1.Сульфат алюминия (х.ч или ч. д. а.), 10 г/л.
2.Гидроксид натрия, 1 г/л.
3.Калибровочные растворы для определения цветности воды.
Порядок выполнения работы
Опыт 1. Определение цветности исследуемой воды
Цветность анализируемой сточной воды определяют фотометрическим методом. Определение проводят на приборе ФЭК при длине волны поглощаемого света400–450 нм(темно-фиолетовый светофильтр).
Порядок работы на ФЭК представлен в прил. 3. Исследуемую пробу помещают в кювету длиной 50 мм. Раствором сравнения является дистиллированная вода.
По калибровочному графику зависимости оптической плотности от цветности раствора определяют цветность исходной сточной воды.
Опыт 2. Определение оптимальной дозы коагулянта
В 5 мерных стаканов емкостью 0,5 л наливают по 300 мл сточной воды. В каждый стакан добавляют 1, 3, 5, 8, 10 мл раствора сульфата алюминия с концентрацией 10 г/л и перемешивают стеклянной палочкой первые 30 с быстро, а затем в течение 3 мин медленно. Оставляют полученные растворы для отстаивания и наблюдают за процессами хлопьеобразования и их осаждения.
Через 20 мин из каждого стакана пипеткой отбирают по 10 мл воды из верхнего слоя и определяют ее цветность по методике, описанной в опыте 1.
Задание
1. Рассчитайте дозы добавляемого в пробы сточной воды коагулянта (г/л), считая, что 1 мл раствора сульфата алюминия содержит
10мг Al2(SO4)3.
По полученным данным постройте коагуляционную кривую и определите оптимальную дозу коагулянта, снизившую цветность исследуемой сточной воды до 20 оС.
2. Рассчитайте, какая масса глинозема Al2(SO4)3·18 H2O (г) необходима для очистки 1 л сточной воды.
29
Опыт 3. Определение влияния рН на эффективность процесса коагуляции
Эффективность коагуляционной очистки зависит от рН сточной воды.
В5 мерных цилиндров емкостью 0,5 л наливают по 350 мл исследуемой воды, затем в них добавляют 2, 5, 8, 10, 12 мл раствора гидроксида натрия с концентрацией 1 г/л, отбирают из каждого стакана по 50 мл и определяют величину рН на рН-метре.
Вкаждый стакан добавляют раствор сульфата алюминия в объеме, равном объему, полученному при определении оптимальной дозы, определенной в опыте 1.
Проводят пробное коагулирование воды, как описано в опыте 2. По полученным данным строят два графика:
– зависимость цветности от величины рН;
– зависимость цветности исследуемой воды от дозы гидроксида натрия.
На основе анализа полученных результатов определите оптимальную дозу гидроксида натрия и величину рН.
Опыт 4. Определение оптимальной дозы коагулянта при подщелачивании раствора
В5 стаканов емкостью 0,5 л наливают по 300 мл сточной воды
идобавляют раствор гидроксида натрия с концентрацией 1 г/л в объеме, соответствующем оптимальной дозе, определенной в опыте 3. Затем в каждую пробу добавляют 1, 3, 5, 8, 10 мл раствора сульфата алюминияи проводятпробноекоагулирование, какописано вопыте2.
По полученным данным строят коагуляционную кривую и определяют оптимальную дозу коагулянта.
На основании проведенных опытов определите оптимальные дозы щелочного реагента и коагулянта.
Задание
1.По полученным данным рассчитайте, какое количество гли-
нозема сернокислого АL2(SO4)3 18Н2О и оксида кальция (техн.), содержащего 60 % СаО, необходимо для очистки 100 м3 воды, подобной исследуемой.
30
