
Лекции_по_биохимии_Сабурова_2_часть
.pdfСледующее заболевание – кетозы, проявляется двумя биохимическими показателями: 1) кетонемия, появление кетоновых тел в крови и 2) кетонурия, выделение кетоновых тел с мочой.
Эти компоненты появляются при нарушении углеводного обмена, при углеводной голодании, при сахарном диабете. При этом ткани организма испытывают энергетический голод, усиленно компенсаторно идѐт распад жирных кислот в результате образуется большое количества ацетил КоА. В норме ацетил КоА вовлекается в ЦТК и там сгорает до конечных продуктов. Он соединяется с ЩУК, образуется лимонная кислота. Но при нарушении углеводного обмена наблюдается дефицит ЩУК.
ацетил КоА накапливается и идет на синтез ацетоновых тел.
Ацетон, ацетоацетат, -оксимасленная кислота относятся к ацетоновым телам и появлении их в крови приводит к ацидозу.
Атеросклероз. В развитии атеросклероза играет генетический фактор и факторы внешний среды (отсутствие физической нагрузки) ожирение, употребление пищи, богатый насыщенными жирными кислотами.
В основе развития атеросклероза лежит то, что в интиме сосудов происходит откладывание холестерина и его эфиров, в виде бляшек. Молекулярные механизмы патогенеза атеросклероза заключаются в том, что происходит повреждение эндотелия сосудов за счет измененной структуры ЛПНП в результате активации свободнорадикального перекисного окисления липидов в составе ЛПНП.
Эти атеросклеротические бляшки затрудняют прохождение крови, нарушается кровоток, который приводит к гипоксии, происходит сужение сосудов. Сосуды теряют эластичность, становятся хрупким.
На фоне атеросклероза развиваются инфаркт миокарда, гипертоническая болезнь.
Биохимические проявления атеросклероза:
1)увеличение в крови ЛПНП
2)увеличение холестерина в крови
3)снижение эфиров холестерина
4)уменьшение соотношения фосфолипиды холестерина
5)уменьшение содержания ненасыщенных жирных кислот. Желчекаменная болезнь – болезнь полных людей, склонных к
перееданию, является нарушением холестеринового обмена. В составе желчи у здоровых
людей ее компоненты находятся в следующем соотношении: желчные кислоты – 12,5%, фосфолипиды - 2,5%, холестерин - 1,0%
При желчекаменной болезни нарушается это соотношение, уменьшаются желчные кислоты, увеличивается холестерин. Холестерин перестает удерживаться в жидком состоянии, переходит в кристаллическое состояние. Это связано с уменьшением желчных кислот, которые удерживают
21
холестерин в жидком состоянии появляются камни, холестериновые или билирубиновые.
Врожденные нарушения липидного обмена.
Врожденные нарушения липидного обмена связаны с мутацией генов и в результате отсутствием тех или иных ферментов, участвуют в расщеплении липидов и это приводит к накоплению в тканях липидов.
Липоидозы – откладывания триглицеридов приводит к ожирению. Эссенциальная холестеринемия характеризуется дефектом фермента, участвуют в обмене холестерина. В результате в печени, селезенке, надпочечниках откладывается холестерин.
Болезнь Нимана – Пика характеризуется тем, что в печени, почках откладываются фосфолипиды.
Болезнь Гоше – в ретикуло-эндотелиальной системе (печень, селезенка) откладываются цереброзиды.
Болезнь Тей-Сакса или семейная амовротическая идионатия связана с отсутствием фермента, вызывающего распад ганглиозидов. В результате ганглиозиды откладываются в головном мозгу и приводит к олигофрении, слепоте,глухоте.
Литература:
А. Основные: 1. Биохимия. Т.Т.Берѐзов, Б.Ф.Коровкин. 2010 2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976 2.Биохимия. Р.Страер. 1985 3.Северин. 2003
22
Лекция № 5 Обмен простых белков
План:
1.Основная роль белков в организме
2.Переваривание белков
3.Всасывание и «гниение» белка в кишечнике. 2.Судьба всосавшихся аминокислот.
Ворганизм поступают азотосодержащие соединения, которые играют большую роль в организме, тогда как углеводы и жиры являются метаболическим топливом.
Азотосодержащие соединения идут на построение клеточных мембран, играют роль гормонов, ферментов, входят в состав нуклеопротеидов.
Основная роль белков в организме:
1) Структурная 2) Защитная 3) Ферментативная 4) Дыхательная
5) Гормональная 6) Транспортная 7) Энергетическая
Без белков нет жизни. Если исключить из рациона белки, это приводит к смерти. Потребность в белке организма зависит от стадии развития индивидуума и от состояния здоровья (например: период выздоровления после перенесенной болезни, беременность, лактация и т.д.). Взрослый человек занимающийся умственным трудом и подвергающейся средней физической нагрузке должен получать 100-120г белка в сутки. При физической работе потребность в белке увеличивается до 130-150г в сутки.
Для поддержания азотистого равновесия достаточно 50г белков в сутки, однако такое количество не обеспечивает сохранения работоспособности и здоровья человека.
Если организм находится на безбелковом питании, то все равно организм теряет в сутки 53мг азота на 1 кг массы тела. Это количество азота умножают на среднюю массу (70кг) и 6.25 (исходя из 16% содержания азота в белках) и получают количество белка, равное 23г.(53мг Х 70 Х 6.25 = 23г). Такое количество белка (23г) постоянно расщепляется в организме при безбелковой диете. Это коэффициент изнашивания.
За сутки организм здорового человека синтезирует около 400г белка, из них 25% подвергается окислительному распаду до конечных продуктов и нуждаются в пополнении извне.
К резервным белкам относятся: белки печени и мыщц.
Аминокислоты делятся на заменимые и незаменимые (валин, лейцин, лизин, метионин, треонин, триптофан, аргинин, гистидин), чем больше в белках незаменимых аминокислот, тем более полноценным считается такой белок. Поэтому для удовлетворения пластических потребностей организма требуется различное количество разных белков пищи.
23
В организме существует азотистое равновесие или азотистый баланс организма. Это разница между количеством азота, поступающего с пищей и количеством выделяемого азота. Такое состояние бывает у здорового человека при нормальном питании.
Азотистый баланс может быть положительным (азот поступает больше, чем выводится), у детей, беременных женщин, у пациентов, выздоровливающих после тяжелых болезней. Отрицательный азотистый баланс (выделяемый азот преобладает над его поступлением), наблюдают при голодании, во время тяжелых заболеваний. При безбелковой диете азотистый баланс становится отрицательным.
Переваривание белков
Главными продуктами богатыми белками являются пищевые продукты животного происхождения (мясо, рыба, яйцо, молоко) и растительного (соя, фасоль, горох).
Переваривание белков начинается в желудке под действием пепсина. Пепсин находится в неактивной форме в виде пепсиногена и активируется под действием соляной кислоты. Под действием НСl белки набухают, происходит денатурация, активируется пепсиноген. Пепсин относится к эндопептидазам, разрывает внутренные пептидные связи между аминокислотами, образуются пептоны, которые поступают в 12перстную кишку. Пептоны расшепляются под действием трипсина, химотрипсина поджелудочной железы.
Трипсиноген активируется под действием кишечной энтерокиназы, образуется трипсин, который в свою очередь активирует химотрипсиноген и превращает его в химотрипсин. Оптимум действия их при РН 7.2 – 8.5. Под действием этих ферментов образуются пептиды, на которые действуют карбоксипептидазы, аминопептидазы и образуются аминокислоты. При различных заболеваниях ЖКТ в желудке нарушается выделение НСl и пепсиногена, при этом переваривание белка заметно снижается. Наиболее часто встречаются патологические изменения кислотности желудочного сока, которые приводят к гастритам: гиперацидному, гипоацидному, анацидному.
Всасывание. Продукты гидролиза белков всасываются в стенке тонкого кишечника в виде свободных аминокислот.
Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам попадает в грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигает через 30-50 мин после приема белковой пищи.
Всасывание - активный процесс, требующей затраты энергии. Энергия поставляется:
1)За счет метаболических процессов, которые происходят в кишечнике.
2)Энергия доставляется за счет активного транспорта ионов Na в клетку. Аминокислоты всасываются и с током крови доставляются к тканям.
24
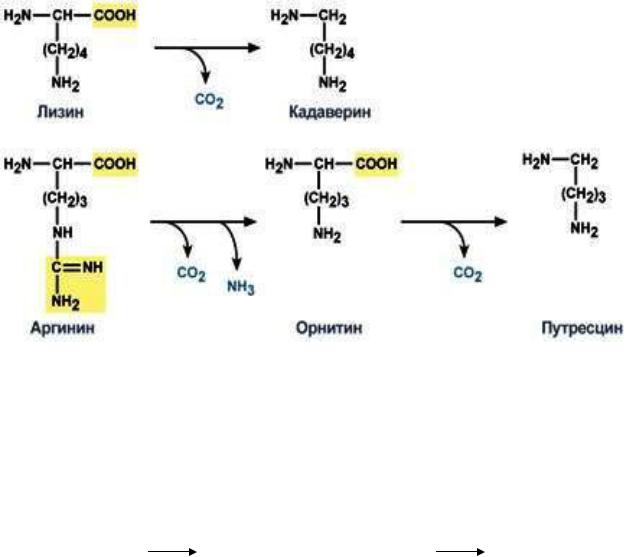
Часто аминокислоты не всасываются и в нижнем отделе толстого кишечника подвергаются «гниению» за счет кишечной микрофлоры, которые эти аминокислоты используют как продукты питания. Микрофлора кишечника располагает набором ферментных систем, которые вызывают :
1)окисление; 2) восстановление; 3)дезаминирование; 4)декарбоксилирование.
Благодаря этому в кишечнике создаются оптимальные условия для образования ядовитых продуктов распада аминокислот, в частности: фенола, индола, крезола, скатола.
Все эти превращения в кишечнике получили название «гниение» белков в кишечнике. Чаще всего «гниению» подвергаются в основном, циклические и основные аминокислоты.
После всасывания эти продукты через воротную вену попадают в печень, где обезвреживаются путем связывания с серной и глюкуроновой кислотами с образованием нетоксичных соединений.
В печени содержатся УДФ-глюкоронидтрансфераза и арилсульфо - трансфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы 3-фосфоаденозин 5- фосфосульфата(ФАФС) и остатка глюкуроновой кислоты из ее связанной формы УДФГК, на любой из указанных высшее продуктов.
Индол + ФАФС индоксил серная кислота индикан который выводиться с мочой .
По количеству индикана в моче судят о скорости процессов «гниения» аминокислот в кишечнике и о функциональном состоянии печени.
У здоровых людей в норме индикан с мочой не выводится. Появляется при колитах, воспалительных процессах в толстом кишечнике.
25
Судьба всасывающихся аминокислот
Поступив через воротную вену в печень, аминокислоты прежде всего подвергаются ряду превращений в этом органе, хотя значительная часть разносится по всему организму и используются для физиологических целей.
В печени аминокислоты используются не только для синтеза собственных белков и белков плазмы крови, но также для синтеза ряда специфических соединений пуриновых и пиримидиновых нуклеотидов, креатина, мочевой кислоты, НАД и т.д.
|
АМИНОКИСЛОТЫ |
углеводы |
мочевина |
липиды |
NH3 |
|
-кетокислоты |
холин |
|
креатин |
меланин |
пептиды |
биогенные амины |
(глутатион, ансерин, |
|
карнитин) |
НАД |
порфирины |
белки, ферменты |
|
гормоны |
Литература:
А. Основные: 1. Биохимия. Т.Т.Берѐзов, Б.Ф.Коровкин. 2010 2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976 2.Биохимия. Р.Страер. 1985 3.Северин. 2003
Лекция №6 Промежуточный обмен аминокислот
План:
1.Реакции дезаминирования, трансаминирования, переаминирования, декарбоксилирования.
2.Роль биогенных аминов.
3.Диагностическое значение определение трансаминаз.
Всосавшиеся аминокислоты, в первую очередь, используются в качестве строительного материала, для синтеза специфических белков, ферментов,
26
гормонов. Некоторое количество аминокислот подвергается распаду с образованием конечных продуктов белкового обмена ( СО2, Н2О, NН3 ) и освобождением энергии.
Аминокислоты, как и белки, не накапливаются и не откладываются в тканях ( наподобие жиров и гликогена ) и у взрослого человека при нормальной обеспеченности пищевым белком поддерживается довольно постоянная концентрация аминокислот в крови – 2,5 г.
Дезаминирование аминокислот – реакция отщепления аминогруппы от аминокислоты, в результате чего образуется кетокислота и выделяется молекула аммиака.
Существует несколько способов дезаминирования аминокислот:
1)Окислительное
2)Непрямое (трансдезаминирование )
3)Восстановительное
4)Внутримолекулярное
Окислительное дезаминирование.
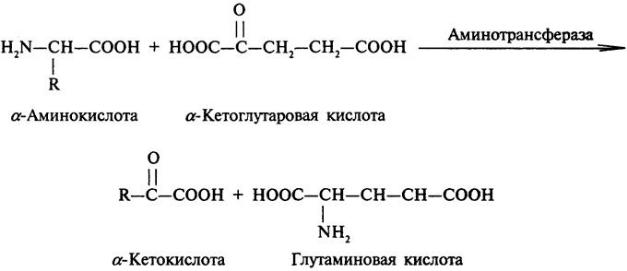
Прямому окислительному дезаминированию подвергается глутаминовая кислота под действием глутаматдегидрогеназы, коферментом, которого является НАД, т.к она активна при рН = 7,4. Остальные аминокислоты подвергаются непрямому или трансдезаминированию.
Реакция идет в 2 этапа. Вначале происходит ферментативное дегидрирование глутаминовых кислот и образование α-аминокислот, затем, неферментативное гидролитическое отщепление иминогруппы в виде NH3 в результате чего образуется α-кетоглутарат.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов кроме мышц . Активна при PH=7.4. Остальные оксидазы активны при PH=10 . Поэтому остальные аминокислоты подвергаются
27
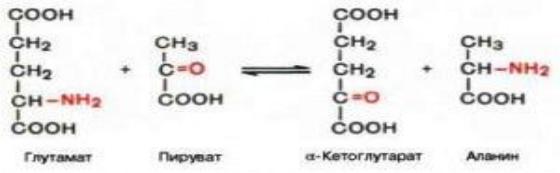
непрямому или трансаминированию ,превращаются в глутаминовую кислоту ,которая затем дезаминируется .
Непрямое трансдезаминирование происходит при участии двух ферментов : аминотрансферезы и глутаматдегидрогеназы .
Трансаминирование происходит с участием трансаминаз ,коферментом которых является фосфопиридоксаль , производное витамина В6 Витамин В6 в печени фосфорилируется, превращается в фосфопиридоксаль, который приняв на себе NH2 группу превращается в фосфопиридоксамин, NH2 оказывается вместо кетогруппы, а фосфопиридоксамин снова преврвщается в фосфопиридоксаль.
Трансаминазы по разному распределяются в различных тканях.
Процесс трансаминирования осуществляется во всех тканях и органах и для каждой аминокислоты имеется своя трансаминаза.
Для диагностических целей наибольшее значение имеет две трансаминазы: АлТ –аланиновая трансаминаза АсТ – аспартатаминотрансаминаза
У здоровых людей в сыворотке крови активность их невысокая. Повреждение тканей, при острых и хронических заболеваниях, сопровождающихся деструкцией ткани, приводят к выходу трансаминаз из очага поражения.
Так, при инфаркте миокарда уже через 3-5 ч. после наступления инфаркта повышается активность АсТ. При гепатите увеличивается активность АлТ.
Вкрови здоровых людей активность АлТ = 0,1 - 0,68 ммоль/л, АсТ = 0,1 – 0,45 ммоль/л.
Большое диагностическое значение имеет определение коэффициента де Ритиса – это отношение АлТ/АсТ = 1,33.
При гепатите коэффициент де Ритиса снижается до 0,65, при инфаркте – больше 1.
Врезультате трансаминирования образуется глутаминовая кислота, которая
дезаминируется с образованием NН3 и кетокислоты. Кетокислота может вовлекаться в различные процессы (цикл Кребса, либо декарбоксилироватся ) NH3- выделяют только рыбы и называют их аммониотелическими .
Все люди выделяют NH3 в виде мочевины и относятся к уреотелическим живым существам . Есть животные которые выделяют N в виде мочевой кислоты .Это –урикотелические существа .
28
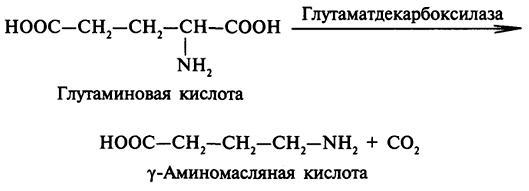
Декарбоксилирование аминокислот
Декарбоксилирование происходит с участием ферментовдекарбоксилаз ,коферментом которых является –фосфопиридоксаль (ФП).Продуктом реакции является СО2 и биогенные амины которые оказывают выраженное биологическое действие на организм , они выполняет функцию нейромедиатров (серотонин, дофамин ,ГАМК и др.) , гормонов (норадреналин , адреналин ) , регуляторных факторов местного действия (гистамин , карнозин).
Серотонин –биогенный амин, стимулирует сокращение гладкой мускулатуры , оказывает сосудосуживающее действие , регулирует артериальное давление , температуру тела, дыхание , является медиатором нервного возбуждения.
Гистамин – обладает сосудорасщирающим действием . Гистамин увеличивает приток крови , расширяя сосуды в очаге воспаления , увеличивает приток лейкоцитов , способствуя борьбе защитных сил организма с инфекцией .
Гистамин участвует в секреции HCL в желудке.
Считают, что гистамину принадлежит важная роль в развитии аллергии (повышенная чувствительность к различным веществам). Имеются антигистаминные препараты (димедрол, тавегил ,супрастин) .
Накопление биогенных аминов может отрицательно сказаться на физиологическом статусе и вызывать ряд серьѐзных нарушуний в организме . Однако органы и ткани как и целостный организм распологают специальными механизмами обезвреживания биогенных аминов, которые в общем виде сводятся к их окислительному дезаминированию с образованием соответствующих альдегидов и освобождением аммиака:
R-СН2-NН2 + Н2О +О2 R-СНО + NН3 + Н2О2
Ферменты, катализирующие эти реакции получили название МАОмоноаминооксидазы. МАО-ФАД-содержащий фермент локализуется в митахондриях, играет исключительно важную роль в организме, регулируя скорость биосинтеза и распада биогенных аминов. Некоторые ингибиторы
29
МАО (ипраниозид, гармин, паргилис) нашли применение при лечении гипертонической болезни, депрессивных состояниях, шизофрении и др.
Литература:
А. Основные: 1. Биохимия. Т.Т.Берѐзов, Б.Ф.Коровкин. 2010 2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976 2.Биохимия. Р.Страер. 1985 3.Северин. 2003
Лекция 7:
Конечные продукты обмена аминокислот
План:
1.Обезвреживание аммиака в организме.
2.Особенности обмена отдельных аминокислот.
3.Обмен креатина.
Аммиак-токсичное соединение. Повышение концентрации NH3 в мозге до 0,6 ммоль, вызывает судороги,тошноту,рвоту,головокружение,потерю сознания.
Обезвреживание NH3 происходит 90%- образование мочевины 6-7%-образование амидов
3-4%-восстановительные аминирование Образование аммонийных солей (в почках)
Свободный NH3 выдыхает только рыбы, птицы выводят в виде мочевой кислоты, человек выводит NH3 в виде мочевины.
1.Синтез мочевины
В40-х годах ХХ-века немецкие биохимики Кребс и Гензелейт установили, что синтез мочевины представляет собой циклический процесс,состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл,является орнитин. Поэтому процесс синтеза мочевины получил название “Орнитиновый цикл” или цикл Кребса-Гензелейта. Синтез мочевины происходит в печени.
30
