
Анемии подробно.
...pdf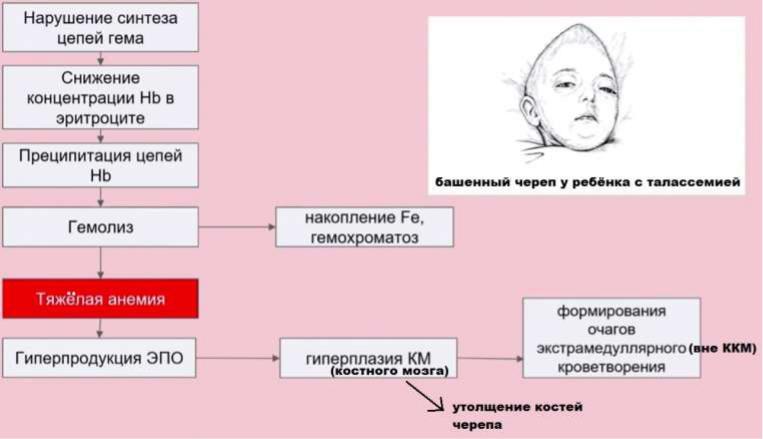
Диагностические критерии талассемии:
Повышение непрямого билирубина.
Гемолитическая желтуха.
В результате формирования очагов экстрамедуллярного кроветворения гепато- и спленомегалия.
Деформация костей черепа, рёбер, скуловых костей, зубов у детей.
Частые инфекционные осложнения в результате избыточного накопления железа в органах иммуногенеза (костный мозг, тимус, лимфоузлы): пневмонии, туберкулёз, менингит, остеомиелит.
Лечение:
Аллогенная трансплантация костного мозга.
Гемотрансфузии с профилактикой гемосидероза (для этого используют дефероксамин (десферал), формирующий комплексы с ионами железа и алюминия, которые выводятся с мочой).
Спленэктомия.
Сидеробластная (сидероахрестическая) анемия
Гетерогенная группа анемий, связанных с нарушением синтеза гема.
Это группа врождённых и приобретённых состояний, при которых в крови наблюдается нормальный (или даже повышенный) уровень железа и ферритина в сочетании с микроцитарной гипохромной анемией.
30
При сидероахрестических анемиях железа в организме достаточно, но по какой-то причине нарушается процесс встраивания этого самого железа в молекулу гемоглобина (отсюда название этой группы заболеваний, от греческого achrestos – бесполезный).
При нарушении созревания гемоглобина в костном мозге накапливаются молодые эритробласты с большим количеством железа, которое накапливаются вокруг ядер. Такие клетки называют сидеробластами (отсюда второе название этих заболеваний).
Ещё одно название – железорефрактерные анемии. Когда врач видит в анализах крови микроцитарную гипохромную анемию, он в первую очередь думает о железодефиците, назначает пациенту препараты железа, но улучшения не получает. Отсюда рефрактерность (невосприимчивость) к железу.
Врождённые сидеробластные анемии
Это группа наследственных заболеваний, связанных с дефектом синтеза протопорфирина (как правило, аминолевулонат-синтазы). Эти заболевания называются порфириями. При таком состоянии не будут синтезироваться нормальные порфириновые кольца, и железу некуда будет встраиваться.
Приобретённые сидеробластные анемии
Чаще всего встречаются в рамках миелодиспластического синдрома. Грубо говоря, это состояние дисплазии гемопоэтических клеток, когда они ещё способны синтезировать нормальные клетки, но в меньших количествах и с большим количеством ошибок. Такое состояние является предгемобластозом, поэтому требует раннего выявления и своевременного лечения.
Другие (редкие) причины сидеробластных анемий включают в себя:
1.отравление алкоголем, лекарственными средствами (изониазидом, пиразинамидом, хлорамфениколом);
2.отравление свинцом (сатурнизм);
3.дефицит меди и витамина B6.
Диагностика
Впериферической крови:
низкие уровни Hb, Ht и MCV,
низкое число ретикулоцитов при высоком уровне железа,
анизоцитоз, пойкилоцитоз.
ВККМ:
гиперплазия эритроидного ростка за счёт кольцевидных сидеробластов.
Лечение
Устранение провоцирующих факторов (при приобретённой форме).
Витаминные (витамин В6) или минеральные добавки.
Рекомбинантный эритропоэтин (ЭПО).
31
Острая постгеморрагическая анемия
Постгеморрагические анемии возникают вследствие острых кровопотерь. Кровотечение – это процесс выхода крови из кровеносных сосудов или полостей тела в окружающую среду, полости организма или межтканевое пространство. Кровопотеря – это клиническое состояние, которое развивается вследствие кровотечения. Это более широкое понятие.
Клиническая картина зависит от направления течения крови (наружное или внутреннее кровотечение), а также скорости кровопотери.
В ответ на кровотечение в организме развивается ряд компенсаторных реакций, направленных на ликвидацию непосредственной угрозы жизни, вызванной снижением ОЦК. Эти реакции развиваются последовательно, поэтому острая постгеморрагическая анемия в своем развитии проходит несколько стадий.
Первая стадия – рефлекторная. Во время кровопотери организм в первую очередь думает, как максимально сохранить ОЦК, так как именно расстройства гемодинамики лежат в основе механизмов гибели организма при данном состоянии. Поэтому потеря форменных элементов организм пока мало волнует. Для того, чтобы терять меньше жидкости, организм сужает сосуды, конечности бледнеют, становятся холодными. Возникает тахикардия, сердце запускается, чтобы быстрее прокачивать оставшийся объём крови. Стоит помнить, что в общем анализе крови все значения рассчитываются относительно объёма крови, этот анализ не показывает абсолютное содержание тех или иных компонентов. Поэтому, несмотря на значительную потерю крови, изменений гематологических показателей может не быть! Рефлекторная стадия возникает непосредственно в фазу активного кровотечения и длится приблизительно сутки после стабилизации общего состояния.
Вторая стадия – гидремическая. Она начинается через 1-2 суток после кровотечения. Организм больше не теряет ОЦК, и теперь его основная задача – восстановить тот объём жидкости, который он потерял. Жидкость из тканевого пула начинает активно перемещаться в сосуды. Объём крови восстанавливается, но только за счёт плазмы, в результате кровь становится «разбавленной». Этот процесс называется гемодилюцией. Наиболее чувствительным в данном случае будет показатель гематокрита, он будет низким, так как форменных элементов мало, а жидкости много. Количество эритроцитов и гемоглобина может тоже быть снижено, так что на этой стадии будут появляться первые признаки анемии. Другие гематологические показатели будут не изменены.
Третья стадия – костномозговая. Она начинается примерно на 5-е сутки после кровопотери. Из-за недостаточного количества эритроцитов организм испытывает состояние гипоксии, и в ответ на неё в организме повышается уровень эритропоэтина. Он действует на красный костный мозг, заставляя предшественников эритроцитов делиться быстрее. В кровь поступает большое количество ретикулоцитов, поэтому постгеморрагическая анемия в развёрнутой стадии является гиперрегенераторной. Если кровопотеря была очень значительной, организм постарается восстановить потерю эритроцитов очень быстро. В таком случае темпы деления клеток могут превышать темпы образования гемоглобина. Тогда анемия будет приобретать вид классической ЖДА с гипохромными микроцитами, пойкило- и анизоцитозом.
32

Также анемия может сопровождаться лейкоцитозом (так как происходит мобилизация клеток под действием симпатической нервной системы) и тромбоцитозом (количество тромбоцитов увеличивается для работы системы гемостаза).
Хроническая постгеморрагическая анемия
Не существует хронической постгеморрагической анемии! Хроническая кровопотеря будет приводить к истощению пула железа, в результате чего будет развиваться ЖДА.
Гипо-/апластические анемии
Гипопластические и апластические анемии – это проявления гетерогенной группы заболеваний и состояний, в основе которых лежит угнетение функции костного мозга. Как правило, происходит угнетение всех ростков гемопоэза, поэтому такие анемии являются составной частью панцитопении. Различие этих 2 типов анемий состоит в том, что при гипопластической анемии функция костного мозга угнетена не полностью, клетки в каком-то количестве всё ещё присутствуют, организм пытается как-то всё это компенсировать. Апластическая анемия характеризуется полной утратой функции костного мозга.
По причине гипо-/апластические анемии можно разделить на 2 группы: врождённые и приобретённые. Врождённые анемии возникают из-за наследственных дефектов в генах, отвечающих за деление и репарацию клеток. Наследственная апластическая анемия, которая затрагивает все ростки кроветворения и часто сочетается с различными аномалиями развития, носит название анемии Фанкони. Наследственная анемия, которая затрагивает только эритроцитарный росток (только анемия без признаков лейкопении и тромбоцитопении) называется анемией Даймонда-Блекфена.
Причины приобретённых гипо-/апластических анемий
33

34
Гемолитические анемии
В норме средняя продолжительность жизни эритроцита – 120 дней, после чего они захватываются макрофагами (в основном в селезёнке и печени) и разрушаются.
Любое нарушение, которое укорачивает период жизни эритроцитов будет стимулировать эритропоэз. Но возможности организма ограничены: считается, что скорость эритропоэза может увеличиться в 6-8 раз. Если скорость деструкции эритроцитов будет превышать компенсаторные возможности организма, будут возникать предпосылки к развитию анемии. Она будет называться гемолитической, то есть связанной с гемолизом – процессом разрушения эритроцитов.
Гемолиз может быть внесосудистым и внутрисосудистым. Внесосудистый (внутриклеточный) гемолиз – это когда эритроциты гибнут там, где им положено (то есть в селезёнке и печени), но в избыточном количестве. Такое бывает, когда организм считает эритроциты дефектными и своевременно выводит их из игры. Внутрисосудистый гемолиз – это когда эритроциты разрушаются в сосудах как правило под действием каких-то внешних факторов, например, токсинов или антител.
Вместе с гибелью эритроцита распадается и его главный белок – гемоглобин. При его распаде образуется билирубин… Избыточное разрушение эритроцитов будет приводить к увеличению преимущественно несвязанного билирубина (непрямой билирубин) в крови, а также продуктов его обмена в моче и кале. Высокий билирубин в крови будет окрашивать кожу и слизистые в жёлтый цвет, а продукты обмена будут делать мочу и кал тёмными. Такой симптомокомплекс будет носить название надпечёночной или гемолитической желтухи.
Помимо желтухи, для гемолитической анемии будет характерен и классический анемический синдром со слабостью, утомляемостью и т.п.
Гемолитическая желтуха – это необязательное проявление гемолитической анемии, особенно хронических её форм. Также желтуха характерна скорее для внутрисосудистого гемолиза, так как билирубин сразу в большом количестве оказывается в крови.
Также важными маркёрами преимущественно внутрисосудистого гемолиза будут гаптоглобин и ЛДГ (лактатдегидрогеназа). Гаптоглобин – это белок, который убирает из крови билирубин. При гемолитической анемии продукция этого белка не увеличивается, а вот его работа значительно возрастает. Гаптоглобин пытается связать весь билирубин, поэтому свободная концентрация гаптоглобина в крови снижается. ЛДГ – это маркёр деструкции тканей, его концентрация в крови, наоборот, возрастает.
В диагностике гемолитических анемий используется проба Кумбса или антиглобулиновый тест. Это тест, который будет говорить о наличии или отсутствии антител против эритроцитов, и, соответственно, поможет определить иммунную природу анемии. Прямая проба Кумбса – это определение антител или наличия комплемента С3 на самом эритроците (на его мембране). Непрямая проба Кумбса – это определение антител против эритроцитов в плазме крови. Таким образом, проведение прямой и непрямой пробы Кумбса может помочь в дифференциальной диагностике различных типов иммунных гемолитических анемий.
35

При хронической гемолитической анемии селезёнка в условиях повышенной нагрузки на неё начинает увеличиваться в размерах, возникает спленомегалия.
Клиника
Сочетание анемического синдрома и гемолитической желтухи
Нормоцитарная нормохромная анемия в крови, как правило, гиперрегенераторная, так как организм пытается стимулировать эритропоэз, чтобы компенсировать гибель эритроцитов.
Гипербилирубинемия, как правило, за счёт непрямого билирубина, появление продуктов обмена билирубина (уробилинов, стеркобилинов) в моче и кале.
Снижение уровня свободного гаптоглобина и повышение уровня ЛДГ (характерно для внутрисосудистого гемолиза).
Спленомегалия (для хронических форм)
Конкретные изменение формы эритроцитов (наличие шизоцитов, акантоцитов и т.п.) для определённых видов гемолитической анемии.
Наличие положительной пробы Кумбса для иммунных форм гемолитической анемии.
Наследственные гемолитические анемии
Наследственные формы гемолитических анемий, как правило, связаны с дефектами в самих эритроцитах. Глобально, дефект может обнаруживаться в 3 системах эритроцита, на чём и будет основана классификация этих анемий:
1.Наследственные мембранопатии. Дефект белков, входящих в состав цитоскелета эритроцитов будет приводить к изменению нормальной формы эритроцитов. Дефектные эритроциты замечаются макрофагами и уничтожаются.
2.Наследственные ферментопатии. Дефект ферментов приводит к нарушению строения гемоглобина или нарушению протекания энергетических процессов в эритроцитах, из-за чего они гибнут.
36
3.Наследственные гемоглобинопатии. Нарушения строения гемоглобина, как правило, приводят к потере нормальной формы эритроцита. А дальше всё по сценарию мембранопатий.
Наследственные ферментопатии
Наследственный дефицит глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ)
Эритроциты очень чувствительны к действию различных внутренних и внешних оксидантов. Чтобы снизить повреждение свободными радикалами, в эритроците работает система естественного антиоксиданта – глутатиона. Для его восстановления необходим фермент глюкозо-6- фосфатдегидрогеназа (Г-6-ФДГ). Наследственный дефицит этого фермента является наиболее частой наследственной ферментопатией, приводящей к развитию гемолитической анемии.
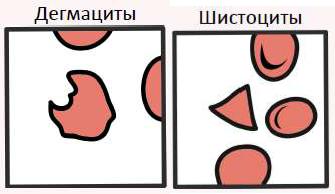
Дефицит Г-6-ФДГ является рецессивным Х-сцепленным заболеванием. Нарушение антиоксидантной системы эритроцита приводит к окислению некоторых групп гемоглобина, в результате чего образуются внутриэритроцитарные тельца Гейнца. Селезёнка замечает дефектные тельца и «откусывает» их, что приводит к формированию характерной для дефицита Г-6-ФДГ форме надкусанных эритроцитов или дегмацитов. Множественные «укусы» приводят к полной потере формы и формированию шистоцитов, которые не способны осуществлять свои эритроцитарные функции.
Как правило дефицит Г-6-ФДГ течёт бессимптомно, пока на организм не подействует какой-то мощный окислитель. Так наиболее часто провоцируют появление симптоматической анемии при дефиците Г-6-ФДГ:
Вирусные или бактериальные инфекции, особенно гепатиты, пневмонии или брюшной тиф.
Лекарственные средства, такие как сульфаниламиды, нитрофураны, хлорохин.
Употребление в пищу конских бобов (Vicia faba). При этом развивается патологическое состояние, называемое фавизмом, с четырьмя основными симптомами: слабость, бледность, желтуха, гемоглобинурия.
Основным проявлением симптоматического дефицита Г-6-ФДГ является гемолитический криз. Это остро возникшее состояние с внутрисосудистым гемолизом, лихорадкой, желтухой и т.п.
Наследственный дефицит пируваткиназы
Пируваткиназа – фермент гликолиза, который является единственным путём получения энергии у эритроцитов. В отсутствии фермента нарушается образование АТФ, что приводит к гибели эритроцитов.
37

Наследственные гемоглобинопатии
Серповидно-клеточная анемия
Одна из наиболее тяжёлых форм наследственных гемолитических анемий. Серповидноклеточная анемия возникает из-за точечной мутации, при которой в β-цепи гемоглобина в шестом положении от амино-конца глутаминовая кислота заменяется на валин. В результате синтезируется патологический гемоглобин НbS. НbS имеет тенденцию к полимеризации, из-за чего образуются длинные цепочки гемоглобина, похожие на иглы, что изменяет форму эритроцита. Образуются дрепаноциты с продолжительностью жизни в 10-15 дней.
Помимо хронического внутрисосудистого гемолиза, клиника серповидно-клеточной анемии связана с развитием микрососудисто-окклюзивных синдромов. Дрепаноциты обладают более выраженными адгезивными свойствами, чем обычные эритроциты, поэтому часто склеиваются и образуют микротромбозы и повреждение тканей. Чаще всего поражаются конечности, лёгкие и селезёнка.
Также к наследственным гемоглобинопатиям относятся талассемии, которые описаны выше.
Наследственные мембранопатии
Наследственный сфероцитоз (болезнь Минковского-Шоффара)
Аутосомно-доминантное заболевание, связанное с наследственным дефектом белков мембраны эритроцитов (спектрина, анкерина и т.п.)
Дефект мембраны приводит к нарушению процессов трансмембранного переноса ионов. В клетке избыточно накапливается Na+, а так как это осмотически активный ион, он тянет на себя воду. Из-за накопления воды эритроциты приобретают форму шара, то есть становятся сфероцитами. Сфероциты более ригидные, чем нормальные эритроциты. Они не могут свободно проникать через мелкие капилляры селезёнки и застаиваются в них. Такое состояние описывают как эритростаз. Макрофаги селезёнки замечают дефектные эритроциты и начинают их избыточно поглощать. То есть возникает внесосудистый гемолиз.
Проявления болезни, характерные для гемолитической анемии: изменение формы эритроцита, ретикулоцитоз, слабая желтуха, спленомегалия из-за застоя эритроцитов и увеличения макрофагов, необходимых для их утилизации.
38

Приобретённые гемолитические анемии
Глобально их разделяют на иммуногемолитические (с положительной реакцией Кумбса) и неиммунные.
Иммуногемолитические анемии
Аутоиммунные гемолитические анемии
Развиваются вследствие образования в организме аутоантител против своих эритроцитов. Как и при всех аутоиммунных заболеваниях, этиология очень сложная, комплексная и до конца непонятная. Часто встречается в сочетании с другими аутоиммунными заболеваниями (ревматоидным артритом, системной красной волчанкой), а также могут возникать у пациентов с гемобластозами. В эту группу входят анемии, индуцированные тепловыми антителами, холодовыми агглютининами (антиэритроцитарные антитела, склеивающие эритроциты) и холодовыми гемолизинами (антиэритроцитарные антитела, разрушающие эритроциты).
39
