
286_p495_B13_2904
.pdf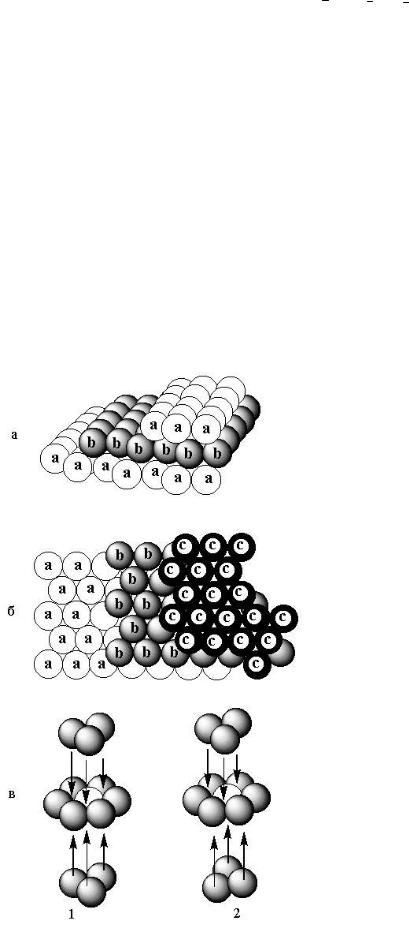
содержат плоскость и ось третьего порядка. Таких групп восемь: P3m1, R3m, P 3 m1, R 3 m, P 6 m2, P63mc, P63/mmc, Fm3m. К ним сводятся все типы структур, построенных по принципам плотной упаковки. Обозначения плотных упаковок приведены в табл. 5.1 и прилож. табл.6, 7, г - гексагональное окружение, типа АВА или ВСВ к – кубическое окружение, типа АВС и САВ
Таблица 5.1.
Простейшие плотные упаковки
Слойность |
Последователь- |
Окружение |
Символ |
Простран- |
|
ность кладки |
слоя |
AST M |
ственная |
|
|
|
|
группа |
2 |
АВС |
ггг |
2Н |
Р63/mmc |
3 |
АВСА |
ккк |
3С |
Fm3m |
4 |
АВАСА |
кгкг |
4Н |
Р63/mmc |
5 |
АВСАВА |
гкккг |
5Н |
P3m1 |
6 |
АВСАСВА |
гккгкк |
6Н1 |
Р63/mmc |
6 |
АВАВАСА |
кгггкг |
6Н2 |
P6m2 |
Трехмерные плотнейшие укладки равновеликих сфер
а- упаковка АВА (гексагональная компактная);

б- упаковка АВСА (гранецентрированная кубическая); в- 1. Положения упаковки АВА; 2. Положения упаковки АВСА.
Рис. 5.3
Символика, которая используется при кристаллохимическом описании структур, указывает слойность упаковки цифрой, а кристаллическую систему ее – буквой (H - гексагональная система, C - кубическая, R- тригональная). Поскольку толщина одного
плотноупакованного слоя составляет (2/3)  6R , где R – радиус сферы, то слойность упаковки можно
6R , где R – радиус сферы, то слойность упаковки можно
вычислить из отношения осей с/а для некубических упаковок. Плотность заполнения пространства при плотной упаковке равных сфер составляет 74,5% безотносительно к типу и слойности упаковки, а координационное число 12.
Пространство между сферами, составляющими плотную упаковку, образует поры упаковки. Между каждыми четырьмя сферами, принадлежащими к двум плотноупакованным слоям, существует тетраэдрическая пора, между каждыми шестью сферами, принадлежащими к трем плотноупакованным слоям, существует октаэдрическая пора. Если радиус сферы плотной упаковки R, а радиус сферы, вписывающейся в пору без потери соприкосновения сфер основной упаковки между собой, r, то размерный фактор r/R тетрапоры составит 0,225, а размерный фактор октапоры 0,415. Число октапор равно числу узлов упаковки, число тетрапор вдвое превышает число узлов упаковки в ячейке.
Число простейших упаковок, содержащих плотноупакованные плоскости или ряды, невелико, поэтому среди структур реальных веществ распространен изоморфизм. Изоморфизмом называется взаимное замещение атомов (или групп) разных химических элементов в эквивалентных позициях кристаллической структуры. Укладка элементов структуры в кристалле с ионной или металлической связью стремится к минимальному объему и максимальной плотности заполнения. Простейшие упаковки равновеликих сфер обладают гексагональной или кубической симметрией. Поэтому крупные анионы ионных кристаллов, равно как и интерметаллиды, образуют одну из плотнейших упаковок. Меньшие по радиусу катионы ионного кристалла, как и более электроположительные частицы интерметаллида, располагаются в порах плотнейшей упаковки, искажая ее вследствие поляризации и сопряженного с ней отклонения ионов от сферической формы. Поэтому можно сформулировать следующее основное правило кристаллохимии: структура кристалла (ионного или металлического) определяется числом структурных единиц, характером плотной упаковки, количеством и качеством заполненных пор и степенью поляризации частиц, слагающих структуру. Отсюда, многие структурные типы должны, поэтому, тяготеть к кубической или гексагональной симметрии. При построении моделей структур и их анализа нет необходимости указывать отдельно положение анионов и катионов. Достаточно правильно расположить в пространстве анионы, координационно тяготеющие к одному катиону, чтобы знать положение катиона, располагающегося в центре объема, образованного центрами тяжести анионов. Подобный объем называется координационным полиэдром и число его вершин равно координационному числу катиона. Простейшими координационными полиэдрами являются: тетраэдр с координационным числом - 4, октаэдр с координационным числом - 6, куб с координационным числом - 8 и кубооктаэдр с координационным числом - 12. (рис.5.4 ).
Первые два полиэдра характерны для заполненных катионами пор плотнейшей упаковки анионов, а последний есть полиэдр координационного окружения основного узла плотнейшей упаковки. Кубооктаэдры существуют в двух вариантах: кубический кубооктаэдр с осью симметрии четвертого порядка и гексагональной - с осью третьего порядка. Устойчивость структурного типа характеризуется координационным соотношением и энергией решетки.
Описание конкретных структур заменяется в кристаллохимии описанием структурных типов, поскольку конкретные структуры, принадлежащие одному типу, отличаются друг от друга лишь линейными размерами осевых трансляций решетки и величинами тех осевых углов, которые заданы в определении кристаллической системы как скользящие. В основу описания структурного типа положены координационное число и координационный полиэдр. Это основные характеристики пространственной организации структуры, а также типичная плоская сетка с наивысшей ретикулярной плотностью заполнения, как основная энергетическая характеристика структуры. Потенциал взаимодействия такой сетки составляет 90% потенциала взаимодействия решетки, описываемого константой Маделунга. Размерный фактор привлекается к этому описанию как определяющий фактор замещения пор в укладках основных частиц структуры. В кристаллах с металлической связью при описании структурного типа указывают электронную конфигурацию в качестве характеристики взаимодействия электронного газа с остовами атомов решетки. В стандартном описании структурного типа указывают также пространственную группу, число занятых в элементарной ячейке узлов и базис. Каждому структурному типу присваивается символ.
В основу классификации положена зависимость строения от вида химической формулы, определяющий состав вещества. На основании сравнения структур кристаллов можно предложить следующую классификацию. Международный символ структурного типа состоит из прописной латинской буквы, большой курсивной цифры и может иметь верхней и нижней индексы. Буквы указывают на стехиометрию структурного типа (А- структуры элементов, В- структуры соединений типа АВ (например, NaCl, CsCl); С- структуры соединений типа АВ2 (например, CaF2, TiO2), D0 –структуры соединений типа АВ3, D1 - структуры соединений типа АВ4 , D2 - AВn, D5- A2B3, D7 - A3B4, D8структуры соединений типа AmBn (например,Al2O3); E и F – структуры соединений, образованные более чем двумя сортами атомов без радикалов или комплексных ионов типа AmBnC (например, CuFeS2) и структуры соединений с двухили трехатомными
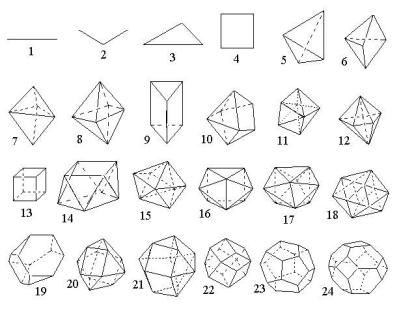
Координационные полиэдры
(в скобках указано координационное число)
1-гантель (1); 2- цепочка (2); 3- треугольник (3); 4- квадрат (4); 5- тетраэдр (4); 6- тетрагональная пирамида (5); 7- тригональная дипирамида (5); 8- октаэдр (6); 9- тригональная призма (6); 10одношапочная тригональная призма (7); 11пентагональный
скаленоэдр (7); 12пентагональная дипирамида (7); 13куб (8); 14квадратная антипризма (свернутый куб) (8); 15тригональный додекаэдр (8); 16двухшапочная тригональная призма (8); 17трехшапочная тригональная призма (9); 18икосаэдр (12); 19притупленный (лавесовский) тетраэдр (12); 20кубооктаэдр (12);
21-гексагональный кубооктаэдр (12); 22ромбододэкаэдр (14);
23-пентагондодекаэдр (2); 24-притупленный октаэдр (24)
Рис.5.4
ионами типа AmBnC ( например, NaHF2, KCNS), H - структуры соединений с пятиатомными ионами (например, CaSO4, CuSO4 5H2O), L - структуры сплавов, S - структуры силикаты. Большая курсивная цифра в типах А, В, С дает порядковый номер структурного типа с данной стехиометрией. Малый нижний цифровой индекс дает номер подтипа, а верхний индекс - указание на то, что данный структурный тип есть вариант дальнего порядка прототипа с меньшей ячейкой.
Типы структур химических соединений
Из 90 структур химических элементов, структуры которых достоверно известны, 68 составляют металлы, 17 - элементы с ковалентной связью, а 5 - благородные газы, в твердом состоянии дающие плотноупакованные кристаллы с ван-дер-ваальсовой связью. 56 металлов способны образовывать плотные упаковки той или иной слойности, в том числе 29 образуют гексагональную плотнейшую упаковку 2Н (структурный тип А3), 22 - кубическую плотнейшую упаковку 3С (структурный тип А1), 4 - четырехслойную плотную упаковку 4Н (Аm ) и I - девятислойную ромбоэдрическую упаковку 9R (Ak). Число металлов, дающих плотные упаковки, с ростом их слойности резко падает. Координационное число этих структур 12, координационный полиэдр - кубооктаэдр и его гексагональный аналог (рис.5.5). Типичные сетки сложены из правильных треугольников, сходящихся по шести к одной вершине. Их символ 36, их
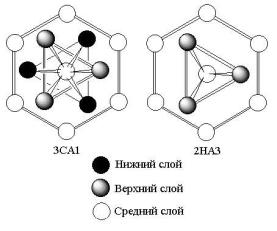
индексы 00.1, в упаковках А3, в структурном типе А1. Следует особо отметить, что сетки 36 во всех плотных структурах, кроме кубической, складываются в параллельные пачки. Это обеспечивает структурному типу А1 меньшую анизотропию, чем в любой другой упаковке. Размерный фактор плотных структурных типов А1, А3... равен единице, поры упаковки пустые.
Координационные полиэдры плотноупакованных структур
а - кубооктаэдр; б - гексагональный кубооктаэдр Рис.5.5
24 металла способны в подходящих условиях (чаще при повышенной температуре) образовывать кубическую плотнейшую упаковку (структурный тип А2). Координационное число на первой координационной сфере составляет 8, но вторая координационная сфера с координацией 6 удалена от первой всего 15%, так учитывая две сферы к.ч.=14. Координационный полиэдр куб для первой сферы и тетрагексаэдр для двух координационных сфер с к.ч.=14.
Пространственную группу обозначают международным символом. Число узлов приводят в числе частиц, а не формульных единиц. Базис дают относительно действующей в пространственной группе системы трансляций. Для получения полного базиса данный в информации базис следует сложить почленно с каждой базисной трансляционной тройкой координат. Периоды решетки соответствуют фазе, указанной в скобках. Именем этой фазы часто обозначают структурный тип в целом. Например:
А1 ( тип меди)
Кубический: Fm3m; N=4, a=3,61A
базис: 1/2 1/2 0; 1/2 0 1/2; 0 1/2 1/2 ) + Cu 000 A2 (тип W)
Кубический: Im3m N=2; a=3, 16 , базис (000, 1/2 1/2 1/2) + 2W: 000
A3 (тип Mg)
Гексагональный: P 63/mmc; N=2; a=3,20A; c=5,20 A базис: 2Mg: 1/3 1/6 1/4; 2/3 1/3 ¾
Структуры химических соединений представляют более 80% всех известных конкретных металлических структур. Последовательность смены этих структурных типов в периодах и группах периодической таблицы Д.И. Менделеева определяется, в конечном счете, разностью собственных электростатических потенциалов решетки, т.е . числом электронов.
Структуры актиноидов, трансуранидов, марганца, олова, индия и ртути отличаются от описанных типичных металлических структур чаще всего по причине различного электронного состояния атомов, слагающих решетку, и реже по причине отклонения формы многоэлектронного атома от сферической.
В типично ковалентных структурах, координационные числа здесь низки, и определяются правилом 8-N, где N - номер группы, координационные многогранники вырождены в плоскость (за исключением алмазной кладки). При плоской координации структурные типы приобретают слоистый характер, в слое действуют ковалентные связи, между слоями – ван-дер-ваальсовые. Размерный фактор ковалентных структур составляет 1.
Твердые растворы замещения, возникающие на основе типичных металлических структур, сохраняют при статистическом распределении их компонентов по узлам решетки растворителя структуру, присущую растворителю, высокие координационнные числа, кубооктаэдрические или кубические координационные полиэдры и тригональные типичные плоские сетки 36. Протяженность твердого раствора замещения определяется разностью радиусов компонентов, их упругими свойствами и электронной концентрацией.
Сверхструктуры. В неупорядоченном твердом растворе трансляционная симметрия соблюдается лишь статистически, а плотность заполнения пространства снижается. Трансляционная симметрия станет вновь строго позиционной, а плотность заполнения пространства вновь возрастает, если узлы в плоских узловых сетках или рядах будут замещены не статистически, а в определенном порядке. При этом в твердом растворе возникает дальний порядок в расположении атомов обоих компонентов по узлам решетки, причем может измениться трансляционная или осевая симметрия сетки решетки. Возникнут новые структурные типы - сверхструктуры.
Диапазон изменения металлических радиусов ýже изменения ионных радиусов, поэтому не все структурные типы ионной связи удобны для реализации металлической связи. Последняя, как известно, представляет взаимное притяжение свободных электронов (электронного газа) и остовов металлизованных атомов, лишенных этих электронов и, следовательно, несущих положительный заряд. Вследствие высокой симметрии такой связи, структурные типы металлической связи обладают высокими координационными числами, высокой плотностью заполнения пространства.
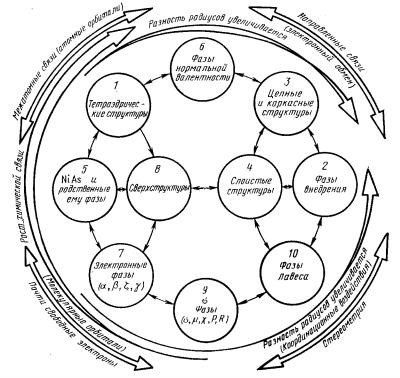
Структурные типы металлической связи можно подразделить на ряд семейств структурных типов сообразно с преобладающими в каждом семействе координационными окружениями и особенностями связями. Схематически соотношения между этими семействами представлены на рис. 5.6.
В порядке увеличения координационного числа среди структур металлических соединений различают следующие семейства структурных типов: 1) тетраэдрические структуры, 2) фазы внедрения, 3) цепные и каркасные фазы , 4) слоистые структуры, 5) фазы типа арсенида никеля, 6) фазы нормальной валентности, 7) электронные соединения, 8) сверхструктуры, 9) фазы переходных металлов, 10) фазы Лавеса. Доля истинно металлической связи, осуществляемой электронным газом в этих соединениях, различна, как и параметры, в которых удобно эту связь описывать. Структурные типы металлической связи обычно группируют в три категории:
1.Фазы нормальной валентности, подобные ионным фазам (1,4-6)
2.Фазы, структура которых определяется, главным образом размерным фактором (2, 3, 10).
3.Фазы, структура которых определяется в основном электронной концентрацией (7, 8, 9)
Семейства структурных типов с металлической связью
Рис. 5.6
отличие от фаз нормальной валентности лишь изредка имеют структурные прототипы, общие со структурными типами ионной связи. Прежде всего, к подобным структурным типам относят фазы
внедрения, сформированные переходным металлом в качестве собственно металлического компонента и водород, азот, углерод и, реже, бор в качестве второго компонента. Поскольку природа связи в фазах внедрения металлическая, а металлические радиусы водорода, азота, углерода и бора малы и составляют соответственно 0,46 Å, 0,71 Å, 0,77 Å, 0,97 Å, то они могут размещаться в порах плотной упаковки. Если плотная упаковка свойственна самим металлам, а позиция пор занята статистически неопределенно, то возникают твердые растворы внедрения. Если же занятые позиции пор приобретают трансляционный порядок, то возникают фазы внедрения. Слойность плотных упаковок в фазах внедрения может отличаться от слойности упаковки в металле.
Фазы, структурные типы которых определяются главным образом электронной конфигурацией, включают сверхструктуры, собственно электронные соединения (фазы Юм-Розери) и фазы, образованные двумя переходными металлами. Фазы Юм-Розери, т.е. β,γ,ε -латуни представляют собой структурные типы, сформированные идеальными или слегка гофрированными сетками. В 1926 г. Юм-Розери показал, что появление указанных выше фаз связано с определенным соотношением между числом валентных электронов и числом атомов в формульной единице кристалла, если считать элементы группы железа нульвалентными, а другим элементам приписать валентность группы, к которой они принадлежат.
Описание кристаллических структур приведено в прилож., табл. 5.
Стандартный план описания кристаллической структуры.
1.Проекция ячейки
2.Тип решетки (с обоснованием)
3.Число формульных единиц (Z)
4.Координационное число и координационный многогранник (для каждого сорта атомов)
5.Характер структуры и тип связей
6.Описание в терминах ПШУ-ПШК, если оно возможно
7.Структурный класс
Примеры описания структур по стандартному плану
NaCl
1. Проекция ячейки:
2.Тип решетки: кубическая гранецентрированная. Обоснование: наличие четырех пересекающихся осей 3- го порядка.
3.Число формульных единиц: Z = 4 NaCl
4.Координационные числа и координационные многогранники:
Na - 6 (октаэдр)
Cl - 6 (октаэдр)
5.Характер структуры, тип связей: гомодесмическая структура с ионными связями
6.Описание в терминах ПШУ:
ионы Cl- образуют трехслойную ПШУ,
ионы Na+ занимают все октаэдрические пустоты
7. Структурный класс: Fm3m, Z = 4(m3m; m3m)
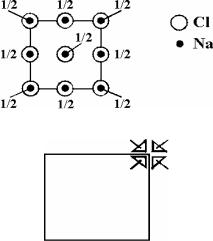
α-графит
1. Проекция ячейки:
2.Тип решетки: гексагональная примитивная. Обоснование: наличие оси 3-го порядка (а также и 63)
3.Число формульных единиц Z = 4
4.Координационное число и координационный многогранник:
(треугольник).
5.Характер структуры, типы связей: гетеродесмическая слоистая; в слоях - ковалентные связи, между слоями - ван-дер-ваальсово взаимодействие
6.В терминах ПШУ-ПШК не описывается
7.Структурный класс P63/mmc, Z = 4([6m2]2)
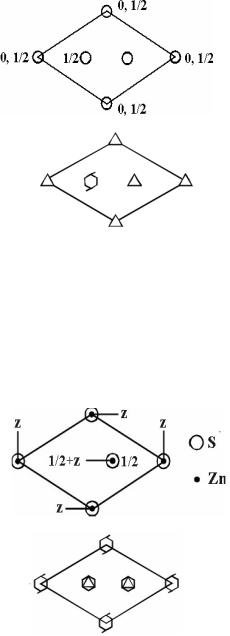
ZnS (вюрцит)
1.Проекция ячейки:
2.Тип решетки: гексагональная примитивная. Обоснование: наличие ось 3-го порядка (а также 63)
3.Число формульных единиц; Z = 2
4.Координационные числа и координационные многогранники:
Zn - 4 (тетраэдр)
S - 4 (тетраэдр)
5.Характер структуры, типы связей: гомодесмическая структура с ковалентными связями
6.Описание в терминах ПШУ:
атомы S образуют двуслойную ПШУ,
атомы Zn занимают половину тетраэдрических пустот
7. Структурный класс: P63mc, Z = 2(3m; 3m)
Планы семинарских занятий: Структуры простых веществ и интерметаллидов
•Приведите примеры металлов, структура которых представляет собой двухслойную плотнейшую шаровую упаковку.
•Приведите примеры металлов, структура которых представляет собой трехслойную плотнейшую шаровую упаковку.
•Приведите примеры металлов, изоструктурных - железу.
•Приведите примеры аномальных кристаллических структур металлов.
•Какую структуру имеют отвердевшие инертные газы?
•Опишите особенности высокотемпературных кристаллических модификаций фтора и кислорода.
•Какое видоизменение кристаллической структуры наблюдается в ряду Cl2, Br2, I2?
•Какое координационное число имеют атомы в кристаллах теллура, мышьяка и германия?
•Каков характер кристаллических структур серого и красного селена?
•Опишите структурные особенности двух кристаллических модификаций азота.
•Каков характер структуры белого, черного и красного фосфора?
•Перечислите важнейшие кристаллические формы углерода.
•Какова координация атома углерода в фуллерене?
•Какова координация атома бора в кристаллическом боре?
•Приведите примеры интерметаллидов со структурами, подобными основным структурным типам металлов.
•Что такое фазы Лавеса? Приведите примеры.
•Чем структура интерметаллида CuAu отличается от структуры сплава того же состава?
Строение кристаллов AX и XY
•Назовите основные структурные типы ионных кристаллов. Каковы координационные числа ионов в этих веществах?
•Чем различаются структуры вюрцита и сфалерита?
•Каков характер кристаллической структуры Cu2O?
•Назовите известные Вам модификации SiO2; укажите их сингонию и соотношение с модификациями углерода.
•Укажите важнейшие различия структур CO2 и SiO2.
•Сколько водородных связей образует молекула воды в кристаллах льда? Как эти связи расположены?
•Чем похожи и в чем различаются структуры BN и графита?
•Приведите примеры островных кристаллических структур из числа простых и бинарных веществ.
•Приведите примеры цепочечных кристаллических структур бинарных соединений AX и XY.
•Приведите примеры слоистых кристаллических структур AX и XY.
•Приведите примеры гомодесмических (монолитных) структур AX и XY с ковалентными связями.
•Опишите мотив заполнения пустот в корунде Al2O3.
•Приведите примеры кристаллических структур AX, где металл имеет координационный многогранник в виде:
а) октаэдра, б) тетрагональной дипирамиды, в) тригональной призмы.
Тема 6. Обобщенная кристаллохимия
Особый интерес представляют сложные химические соединения, типа клатратных, жидких кристаллов или квазисоединений. В этих соединениях часто наблюдается сверхпроводимость, которая до сих пор наблюдалась у металлов или интерметаллических соединений. Без кристаллохимических исследований невозможно сделать сколько-нибудь разумное предположение о структуре таких сложных соединений как силикаты, некоторые органические соединения, клатраты, π-комплексы и прочие.
Кристаллохимия располагает тремя крупнейшими эмпирическими обобщениями, которые можно назвать категориями: морфотропия, полиморфизм, изоморфизм.
Морфотропией называется резкое изменение кристаллической структуры в закономерном ряду химических соединений при сохранении количественного соотношения структурных единиц. Например, сфалерит (ZnS), троилит (FeS), ольдгамит (CaS) принадлежат к трем различным структурным типам: сфалерита, никелина и галенита соответственно. Изменение структуры вызвано заменой катиона при том же анионе и отношением атомных количеств катиона и аниона 1:1. Грот также обратил внимание на то, что под влиянием закономерного замещения химически составных частей некоторого ряда соединений в определенном месте наступает изменение кристаллической формы. Он назвал морфотропию (буквально - поворот формы). Например, ряд карбонатных минералов - магнезит (MgCO3), сидерит (FeCO3), родохрозит (MnCO3), кальцит (CaCO3), кристаллизуются в структуре типа кальцита, а арагонит (CaCO3), стронцианит (SrCO3) и витерит (BaCO3) – в структуре типа арагонита. Значит именно карбонат кальция, имеющий две структурные модификации, попадает в этом ряду на границу морфотропного перехода. Морфотропия – соответствует закону Гаюи: химически различные вещества обладают и различным химическим строением.
Изоморфизм – взаимное замещение химически различных компонентов в эквивалентных позициях кристаллической структуры. Например: сфалерит (ZnS), метациннабарит (HgS) изоструктурны и изоморфны, т.к. возможно образование смешанных кристаллов (твердого раствора замещения) состава (Zn, Hg )S с различным соотношением количеств Zn, Hg.
Полиморфизм – изменение кристаллической структуры некоторого вещества при изменении кристаллической структуры некоторого вещества при изменении термодинамических условий. Например, при высокой температуре ZnS стабилен в гексагональной структуре вюрцита, при низкой – в кубической сфалерита. Низкотемпературная форма HgS - тригональная киноварь.
Гольдшмидт указал на то, что при внешнем различии все три категории кристаллохимически связаны между собой взаимными переходами. Относительные размеры структурных единиц изменяются под действием внешних факторов. Так, давление относительно сильнее уменьшает радиус крупного и рыхлого аниона, чем катиона в ионных кристаллах. Повышение температуры, наоборот, сильнее увеличивает размер аниона, чем катиона. Поэтому полиморфизм можно рассматривать как изменения отношения размеров катиона и аниона при постоянном составе и называется автоморфотропией.
Однако следует помнить, что эта трактовка не является исчерпывающей, а лишь хорошо подчеркивает связь между этими категориями. Современные знания по кристаллохимии позволяют ввести еще одно понятие - структурная гомология, которую можно определить как существование гомологических рядов кристаллических структур. Структурная гомология, имеет дело с постепенностью структурных изменений дискретных членов ряда в противоположность морфотропии, которая описывает резкое изменение структуры. Типичные гомологические ряды химических составов и кристаллических структур известны для пирротинов, уранинитов, оксидов титана, молибдена и других.
Структуры с полианионами, состоящими из нескольких видов атомов, встречаются в огромном количестве. К ним можно отнести производные с карбонатным радикалом, сульфатным и фосфатным. Чаще всего их удобно описывать как бинарные соединения. Группировки считать как один фрагмент. Так известно, что карбонатный ион имеет форму плоского треугольника, сульфатный и фосфатный ионы – тетраэдр. Остановимся на классе силикатов, который является важнейшим среди структур с полианионами.
Силикаты являются одним из наиболее сложных по химическому составу классов неорганических веществ. Они включают вещества, содержащие кремний и кислород вместе со многими элементами. Многие силикаты нерастворимы в воде, затруднительно и их структурно - химическое изучение обычными методами. Поэтому ни для одного из классов веществ не было предложено такого количества различных вариантов гипотетических структурных формул и все они без исключения оказались неверными. После появления рентгеноструктурного анализа стало возможным правильно выяснить структурную формулу силикатов. И это явилось триумфом кристаллохимии, что коренным образом изменило представление о силикатах.
Большая часть доступных для нас веществ - более чем 90% земной коры - состоит из силикатов; даже если мы не упомянем об их широчайшем применении в промышленности, уже этот факт сам по себе говорит об исключительной важности. Трудность химического изучения силикатов связана, прежде всего, со сложностью химического состава. В силикатах нередко встречаются одновременно 3, 4 и большее число различных катионов. Для силикатов чрезвычайно характерны изоморфные замещения как катионов, так и самого кремния и вхождение в силикаты других анионов (O2-, OH-, F-, SO42-, CO32-) и нейтральных частиц - H2O и др. Метод катионных многогранников особенно успешно был применен Н.В. Беловым для изучения структур многих минералов, относящихся к классу силикатов, и создания ряда важнейших разделов кристаллохимии силикатов. В течение длительного времени силикаты рассматривались в качестве солей нескольких гипотетических кремневых кислот, формулы которых выводили по аналогии с формулой нормальной ортокремневой кислоты: H4SiO4 (ортокремневая), H2SiO3 (метакремневая), H6Si2O7 (ортодикремневая), H2Si2O5 (метадикремневая). Эти формулы сыграли определенную прогрессивную роль в минералогии. Некоторые силикаты имеют названия, являющиеся производными от указанных кислот. До определения структуры оливина была известна только структура циркона (ZrSiO4) и граната-гроссуляра (Ca3Al2(SiO4)3). Выяснилось, что структура всех силикатов основана на тетраэдрических ионах SiO4 (которые обнаружены также и в различных модификациях SiO2), по существу, с одинаковыми размерами. Конечно, в SiO2 каждая вершина тетраэдра является общей с вершиной другого тетраэдра; таким образом, кислород одновременно принадлежит двум тетраэдрам. В силикатах сочетаются ионные и ковалентные типы химических связей. Значительно меньшую роль в них играют ван-дер-ваальсовые и водородные связи. Подобная координация кремния по отношению к кислороду определяется величинами их ионных радиусов R(Si4+) : R(O2-) = 0,43. Кремнекислородные тетраэдры могут находиться в структурах силикатов либо в изолированном виде, либо сочетаться в отдельные изолированные группы, либо создавать бесконечные линейные, слоистые или каркасные радикалы. Соединение подобных простых или сложных радикалов осуществляется посредством положительно заряженных катионов.
Вследствие близости размеров некоторых других катионов к Si4+ (Al3+, Fe3+, Cr3+) кремнекислородные тетраэдры в некоторых минералах могут замещаться соответственно алюмокислородными, железо-кислородными, хромкарбидными и т.п. тетраэдрами. Все это обуславливает удивительное разнообразие типов химических соединений, относимых к минералам класса силикатов.
В основу современной кристаллохимической классификации силикатов положен характер расположения и взаимное сочетание таких кремнекислородных тетраэдров в кристаллических решетках силикатов.
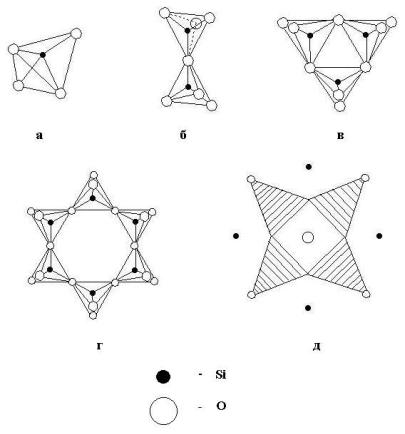
Наиболее распространена следующая классификация силикатов:
1. Островные силикаты с изолированными кремнекислородными радикалами (рис.6.1): а) островные с одиночными изолированными радикалами;
б) островные с двойными, тройными, четверными, шестерными изолированными радикалами
2.Цепочечные силикаты с бесконечными линейными кремнекислородными радикалами (рис. 6.2).
3.Слоистые силикаты с бесконечными двухмерными кремнекислородными радикалами (рис. 6.3, рис. 6.4).
Кремнекислородные островные радикалы
а- SiO44- б- [Si2O7]6- в- [Si3O9]6- г- [Si6O18]12- д- [Si4O12]7-.
Рис. 6.1
