
новая папка 2 / 123525
.pdf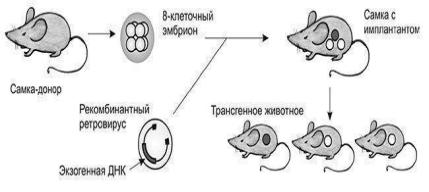
Пересадка трансфицированных ядер. При этом используют-
ся ядра клеток, отобранные на основе трансгенной интеграции, то есть пересаживаются только трансгенные эмбрионы. Поэтому любой новорожденный организм будет трансгенным. Последующая селекция трансгенных эмбрионов не требуется.
Использование сперматозоидов в качестве векторов экзо-
генной ДНК. При этом сперматозоиды могут быть взяты от одного самца и пересажены в семенники самца того же или другого вида. Там они становятся функционирующими.
Ретровирусные векторы также используются для получения трансгенных животных. Инфицирование предимплантационных эмбрионов рекомбинантными ретровирусами – относительно несложная эффективная процедура.
Восьмиклеточную морулу (рис.1) освобождают от яйцевой оболочки и помещают в культуральную чашку с фибробластами, продуцирующими рекомбинантный ретровирус. Инфицированные эмбрионы, достигшие стадии бластулы, имплантируют псевдобеременным самкам. В результате формируются трансгенные организмы, мозаичные по числу и локализации встроек рекомбинантной ДНК в геном. Поэтому для получения чистых линий далее необходим масштабный аутбридинг.
Рис.1 Схема получения линии трансгенных мышей с использованием ретровирусных векторов
Недостатком метода является ограничение вставки экзогенной ДНК, вследствие чего трансген может оказаться лишенным
11
прилегающих регуляторных последовательностей, необходимых для его экспрессии, а в некоторых случаях интеграция в исходный локус нестабильна. Новые лентивирусные векторы (лентивирусы принадлежат семейству ретровирусов) показали свою очень высокую эффективность при доставке ДНК в ооциты и зиготы. Инъекция рекомбинантных лентивирусных конструкций в перивителлиновое пространство свиных зигот и коровьих ооцитов привело к появлению потомства с самой высокой на данный момент долей трансгенных особей. В то же время лентивирусные векторы обладают всеми недостатками ретровирусных: малый размер вставки экзогенной ДНК и множественная интеграция в хозяйский геном, которая может привести к таким нежелательным побочными эффектам, как активация онкогенов и инсерционный мутагенез. Кроме того, для лентивирусных векторов наблюдается высокая степень мозаичности получаемого трансгенного потомства и отдельные факты сайленсинга (инактивации) лентивирусных рекомбинантных последовательностей в полученных трансгенных линиях.
Использование ретровирусных векторов имеет и еще один большой недостаток. Хотя эти векторы создаются так, чтобы они были дефектными по репликации, геном штамма ретровируса (вируса-помощника), который необходим для получения большого количества векторной ДНК, может попасть в то же ядро, что и трансген. Несмотря на все принимаемые меры, ретровирусыпомощники могут реплицироваться в организме трансгенного животного, что совершенно недопустимо, если этих животных предполагается использовать в пищу или как инструмент для получения коммерческого продукта. И поскольку существуют альтернативные методы трансгеноза, ретровирусные векторы редко используются для создания трансгенных животных, имеющих коммерческую ценность.
Преимущества использования ретровирусных векторов:
1.Почти 100 % эмбрионов, обработанных ретровирусом, могут быть инфицированы.
2.Возможность проведения генной терапии наследственных заболеваний.
3.Ретровирусы делают возможной трансформацию отдельных органов (например, молочных желез для повышения удоя).
12
Недостатки использования ретровирусных векторов:
1.Ограниченная емкость.
2.Подавление экспрессии трансгенов in vivo.
3.Низкий титр (решена при помощи псевдотипирования).
4.Возможность клеточных онкогенов.
5.Невозможность передачи по наследству трансформации отдельных органов.
Трансгенных животных получают и для целей ксенотрансплантации. Одним из доноров органов являются свиньи, так как имеется анатомическое сходство органов и сходство иммунологических свойств. Реакции отторжения при трансплантации имеют сложный механизм. Одним из сигналов для атаки организма на чужой орган являются белки, локализованные на внешней поверхности мембраны. У трансгенных свиней эти белки заменены на человеческие.
Еще одно направление трансгеноза – получение устойчивых
кболезням животных. Животноводство держится на вакцинах, так как селекция ведется преимущественно на хозяйственно ценные признаки – шерсть, молочность и т. д. Повышение устойчивости – дело генных инженеров. К защитным белкам относятся интерфероны, поэтому ген интерферона встраивали различным животным. Трансгенные мыши получили устойчивость, они не болели или болели мало, а вот у свиней такого эффекта не обнаружено.
Трансгенных животных можно использовать для изучения наследственных заболеваний мозга и нервной системы. Гены болезни Альцгеймера (отложение белка β-амилоида приводит к образованию характерных бляшек) и гены, отвечающие за развитие эпилепсии, болезней мозга вводятся в геном нормальных животных; при этом получают трансгенных животных-моделей, на которых можно испытывать различные терапевтические приемы.
Трансгенных животных стали использовать для исследования воспалительных и иммунологических заболеваний человека, например, ревматоидного артрита.
Задания
1.Составьте схему получения трансгенных животных.
2.Напишите последовательность и основные операции создания трансгенных животных.
3.Укажите преимущества генной инженерии над селекцией при совершенствовании пород сельскохозяйственных животных.
13
Контрольные вопросы
1. Перечислите основные методы получения трансгенных живот-
ных.
2.Для каких целей получают трансгенных животных?
3.Каких животных называют трансгенными?
4.Какие преимущества имеют трансгенные животные по сравнению
срекомбинантными микроорганизмами в получении ценных фармакологических веществ?
5.Назовите недостатки использования ретровирусных векторов?
6.Назовите преимущества использования ретровирусных векторов?
7.В чем суть метода микроинъекции?
ЗАНЯТИЕ 7-9. ОПЛОДОТВОРЕНИЕ ЯЙЦЕКЛЕТОК ВНЕ ОРГАНИЗМА ЖИВОТНОГО
Цели занятия. Рассмотреть методы, схемы оплодотворения in vitro; изучить принципы и подходы, используемые в оплодотворении вне организма.
Разработка системы оплодотворения и обеспечения ранних стадий развития эмбрионов млекопитающих вне организма животного (in vitro) имеет огромное значение в решении ряда научных задач и практических вопросов, направленных на повышение эффективности разведения животных.
Для этих целей необходимы эмбрионы на ранних стадиях развития, которые можно извлечь только хирургическими методами из яйцеводов, что является трудоемким процессом и не дает достаточного числа зародышей для проведения этой работы.
Оплодотворение яйцеклеток млекопитающих in vitro включает следующие основные этапы: созревание ооцитов, капацитацию сперматозоидов, оплодотворение и обеспечение ранних стадий развития.
Созревание ооцитов in vitro. Большое число половых клеток в яичниках млекопитающих, в частности у крупного рогатого скота, овец и свиней с высоким генетическим потенциалом, представляет источник огромного потенциала воспроизводительной способности этих животных в ускорении генетического прогресса по сравнению с использованием возможностей нормальной овуляции. У этих видов животных, как и других млекопитающих, число
14
ооцитов, овулирующих спонтанно во время охоты, составляет только незначительную часть от тысяч ооцитов, находящихся в яичнике при рождении животного. Остальные ооциты регенерируют внутри яичника или, как говорят обычно, подвергаются атрезии. Естественно возникал вопрос, нельзя ли выделить ооциты из яичников путем соответствующей обработки и провести их дальнейшее оплодотворение вне организма животного. В настоящее время не разработаны методы использования всего запаса ооцитов в яичниках животных, но значительное число ооцитов может быть получено из полостных фолликулов для дальнейшего их созревания и оплодотворения вне организма.
Внастоящее время применение на практике нашло созревание in vitro только ооцитов крупного рогатого скота. Ооциты получают из яичников коров после убоя животных и путем прижизненного извлечения, 1-2 раза в неделю. В первом случае яичники берут от животных после убоя, доставляют в лабораторию в термостатированном контейнере в течение 1,5-2,0 ч. В лаборатории яичники дважды промывают свежим фосфатным буфером. Ооциты извлекают из фолликулов, диаметр которых 2-6 мм, путем отсасывания или разрезания яичника на пластинки. Ооциты собирают в определенную среду, с добавлением 10 % сыворотки крови от коровы в охоте, затем дважды промывают и отбирают для дальнейшего созревания in vitro только ооциты с компактным кумулюсом и однородной цитоплазмой.
Впоследнее время разработан способ прижизненного извлечения ооцитов из яичников коров с помощью ультразвукового прибора или лапароскопа. При этом ооциты отсасывают из фолликулов, диаметр которых не менее 2 мм, 1-2 раза в неделю от одно-
го и того же животного. В среднем получают однократно 5-6 ооцитов на животное. Менее 50 % ооцитов пригодны для созревания in vitro.
Положительное значение – несмотря на низкий выход ооцитов, при каждом извлечении возможность многократного использования животного.
Капацитация сперматозоидов. Важным этапом в разработке метода оплодотворения у млекопитающих было открытие явления капацитации спермиев. В 1951 г. М.К. Чанг и одновременно с ним Г.Р. Аустин установили, что оплодотворение у млекопитающих наступает только в том случае, если спермии в течение нескольких
15
часов до овуляции находятся в яйцеводе животного. Основываясь на наблюдениях по изучению проникновения спермиев яйцеклетки крысы в различные сроки после спаривания Аустин ввел термин капацитации. Он означает, что в спермии должны произойти некоторые физиологические изменения до того, как сперматозоид приобретет способность к оплодотворению.
Разработано несколько методов капацитации эякулированных спермиев домашних животных. Для удаления белков с поверхности спермиев, которые, по-видимому, тормозят капацитацию спермиев, была использована среда с высокой ионной силой.
Однако наибольшее признание получил способ капацитации сперматозоидов с использованием гепарина. (Дж. Парриш и др., 1985). Пайеты с замороженным семенем быка оттаивают в водяной бане при 39°С в течение 30-40 с. Примерно 250 мкл оттаянного семени подслаивают под 1 мл среды для капацитации. Среда для капацитации состоит из модифицированной среды Тиройда, без ионов кальция. После инкубации в течение одного часа верхний слой среды объемом 0,5-0,8 мл, содержащий большинство подвижных сперматозоидов, удаляют из пробирки и промывают дважды центрифугированием в течение 7-10 мин. После 15 мин инкубации с гепарином (200 мкг/мл) суспензию разбавляют до концентрации 50 миллионов сперматозоидов в мл.
Оплодотворение in vitro и обеспечение ранних стадий раз-
вития эмбрионов. Оплодотворение яйцеклеток у млекопитающих осуществляется в яйцеводах. Это затрудняет доступ исследователя к изучению условий среды, в которой происходит процесс оплодотворения. Поэтому система оплодотворения in vitro была бы ценным аналитическим инструментом для изучения биохимических и физиологических факторов, включающихся в процесс успешного соединения гамет.
Применяют следующую схему оплодотворения in vitro и культивирования ранних эмбрионов крупного рогатого скота. Оплодотворение in vitro проводят в капле модифицированной среды Тироида. После созревания in vitro ооциты частично очищают от окружающих экспандированных кумулюсных клеток и переносят в микрокапле по пять ооцитов в каждой. Суспензия сперматозоидов объемом 2-5 мкл добавляется к среде с ооцитами, чтобы достичь концентрации сперматозоидов в каплях 1-1,5 млн/мл. Через 44-48 ч после осеменения определяют наличие дробления
16
ооцитов. Затем эмбрионы помещают на монослой эпителиальных клеток для дальнейшего развития в течение 5 дней.
Межвидовые пересадки эмбрионов и получение химерных животных. Животные – химеры несут в одном организме признаки обоих эмбрионов, отличающихся между собой разными генотипами.
Пересадка эмбрионов, например, овец козам и наоборот сопровождается их приживляемостью, но не завершается рождением потомства. Во всех случаях межвидовых беременностей непосредственной причиной абортов является нарушение функции плаценты за счет иммунологической реакции материнского организма на инородные антигены плода. Эта несовместимость может быть преодолена получением химерных эмбрионов с помощью микрохирургии.
Клонирование животных. Ядро соматической клетки обладает полной генетической информацией о данном организме. Если создать условия для реализации этой информации, то можно получить неограниченное число генетических копий (клонов) определенной особи.
Получение однояйцовых близнецов – имеет большое значе-
ние для животноводства. При этом увеличивается выход телят от одного донора, появляются генетически идентичные двойни. Для этого эмбрионы млекопитающих на ранних стадиях развития разделяют микрохирургическим путем на две или более частей. Они в последующем развиваются в отдельный организм. Разделенные эмбрионы коров могут храниться в замороженном состоянии.
Клонирование эмбрионов путем пересадки ядер эмбриональных клеток в энуклеированные (лишенные ядра) яйце-
клетки. Включает следующие этапы: выделение интактного ядра донора; энуклеация ооцита; пересадка ядра в энуклеированную яйцеклетку; активация ооцита и слияние мембран яйца и ооцита под действием электрического импульса.
Данная технология позволяет получить из отдельной эмбриональной клетки множественные копии генетически одинаковых животных (до 64). Повторное клонирование полученных этим методом эмбрионов повышает потенциальные возможности технологии в производстве большого числа клонов.
Клонирование животных путем пересадки ядер соматических клеток в энуклеированные яйцеклетки – метод позволяет
17
получить не только одинаковых между собой животных, но и идентичных по генотипу с животными-донорами соматических клеток. Эта технология может быть использована для сохранения исчезающих пород животных.
Задания
1.Дать определение «химера», «химерное животное».
2.Способы получения внутривидовых и межвидовых животных-
химер.
3.Записать основные этапы получения химер.
4.Написать основные этапы получения клонированных животных.
5.Зарисовать схему получения овцы Долли.
Контрольные вопросы
1.Опишите технологию оплодотворения яйцеклеток млекопитаю-
щих in vitro?
2.Опишите межвидовые пересадки эмбрионов?
3.Какие применяют методы клонирования животных?
4.Что такое капацитация сперматозоидов?
5.Назовите методы капацитации спермиев?
6. Расскажите о результатах исследований по совершенствованию процесса созревания яйцеклеток вне организма?
Занятие 10-12. БИОТЕХНОЛОГИЯ И БИОБЕЗОПАСНОСТЬ
Цели занятия. Рассмотреть проблемы биобезопасности человека, общества, государства и цивилизации; изучить критерии и показатели биобезопасности ГМО.
Природные, техногенные и другие факторы оказывают постоянное и значительное воздействие на человека и среду его обитания. Эти воздействия могут быть положительными и отрицательными. Наука, общество, государство должны разрабатывать и эффективно использовать системы мер по защите человека и окружающей среды от вредных воздействий любых опасных факторов. Жизнь человека и общества, существование и деятельность государства должны быть надежно защищены от любых внутренних и внешних воздействий. Отсюда вытекает общее понятие о безопасности человека, общества, государства, цивилизации, под
18
которым понимается устойчивое состояние защищенности жиз-
ненно важных |
интересов личности и самой |
жизни |
челове- |
ка, общества и государства от внешних и внутренних угроз. |
|
||
Главнейшим |
объектом безопасности |
является |
чело- |
век. Безопасность человека не может быть обеспечена без защиты среды его обитания и жизнедеятельности, без защиты общества, в котором он живет. Одним из основных принципов безопасности является взаимная ответственность человека, общества и государства. Безопасность может быть биологической, экологической, экономической, продовольственной, военной и др.
Проблемы биобезопасности существуют в мире давно, т.к. и в природе, и в производстве различных, необходимых человеку и обществу веществах – продуктах питания, гигиены, лекарствах и других нередко встречаются и продукты, содержащие опасные для здоровья и жизни человека соединения.
Во всех государствах мира разработан контроль за технологическими процессами и качеством вновь вовлеченных в сферу использования человеком новых биологических объектов и веществ, их токсичностью, аллергенностью и общей безопасностью для здоровья людей и состояния окружающей среды.
Биотехнология изменяет фундаментальные свойства организмов: наследственность, изменчивость, энерго- и массообмен, адаптацию и устойчивость, продуктивность и качество. Такое искусственное вмешательство в генетические структуры не позволяет всегда точно прогнозировать возможные последствия. Это вызывает большое беспокойство людей, что может затормозить развитие биотехнологии и особенно биоинженерии.
Биобезопасность – это защищенность человека и окружающей среды от вредного воздействия различных биологических соединений, содержащихся в природных или генно-инженерно- модифицированных биологических объектах и полученных из них продуктах. Биобезопасность важна не только для человека, но и для растений, животных и полезных микроорганизмов.
Манипуляции с растительными и животными клетками и их органеллами основаны на фундаментальных свойствах клеток и тканей, тотипотентности, соматической гибридизации, дифференциации. В клеточных технологиях постоянно используется спонтанный и направленный мутагенез. Это приводит к генетической гетерогенности клеток. Исходя из этого, в клеточных биотехнологиях должен быть построенный мониторинг полученных мутантов.
19
Они должны иметь устойчивые генотипы, так как распространение неустойчивых мутантов может привести, например, в сельском хозяйстве к большим потерям урожая.
Биотехнологические процессы нужно непрерывно контролировать и своевременно выявлять возможные отклонения от нормы основных параметров и качества продукции. Показано, что при работе с животными тканями и клетками возможно накопление токсических веществ, необычных продуктов метаболизма. Считают, что клеточная биотехнология растений (селекция сортов, получение продуктов для фармацевтической и пищевой промышленности) более безопасна, чем использование клеточных и тканевых технологий в животноводстве.
При проведении рДНКбиотехнологии важной проблемой является возможность получения мутантов с содержанием токсичных или аллергенных для человека белков или других опасных соединений. Не исключено, что при трансгенозе могут активироваться «молчащие» гены, поэтому вероятно появление генотипов, опасных для здоровья и жизни человека. Возможность появления таких мутантов значительно возрастает при использовании искусственных, синтетических генов для трансгенных растений, животных и микроорганизмов с улучшенными и принципиально новыми свойствами. Не исключено также взаимодействие полученных модифицированных генов с генами третьих генотипов, что может привести к становлению новых генотипов с опасными свойствами для людей и окружающей среды.
Однако 30 лет интенсивных работ в области новейшей биотехнологии – генетической инженерии – показывают их безопасность. Это объясняется исходя из следующих основных положений:
1.В биоинженерных работах используются природные гены, которые за все время эволюции подвергались отбору, элиминации, рекомбинации и т.д. В результате этого выработались механизмы, которые обеспечивают устойчивый характер репарации биосинтеза белков и их качества.
2.В биоинженерных лабораториях постоянно проводится мониторинг за качеством получаемых трансгенных организмов. Это позволяет заблаговременно, на этапе создания генетическимодифицированных объектов (ГМО) в лаборатории, выявить опасные генотипы и не допускать их в производство.
20
