
новая папка 1 / 296133
.pdfна примере диаграммы кипения «температура – состав» (P=const) для двухкомпонентной системы без азеотропа (диаграмму выберите в спра- вочнике).
16.Покажите на диаграмме, до какой температуры следует нагреть жидкую систему произвольного состава, чтобы количества равновесных жидкой и паровой фаз были одинаковы?
17.Анализ диаграмм «давление-состав», «температура-состав» и «со- став пара-состав жидкости» для систем, не образующих азеотроп.
18.Равновесие «жидкость-пар» в двухкомпонентных системах. Диа- граммы «давление-состав», «температура-состав», «состав пара-состав жидкости» для систем с положительными отклонениями от закона Рауля.
19.Основы разделения жидких бинарных смесей перегонкой и ректи- фикацией. Коэффициент разделения.
20.Равновесие «жидкость – пар» в двухкомпонентных системах с пол-
ной взаимной растворимостью в жидкой фазе. Законы Гиббса-Коновалова. Азеотропные смеси.
21.Законы Гиббса-Коновалова. Разделение жидких смесей перегонкой
иректификацией.
22.Диаграммы кипения бинарных систем с полной взаимной раствори- мостью компонентов. Законы Гиббса-Коновалова. Применение правила фаз к исследованию диаграмм кипения.
23.Системы практически несмешивающихся друг с другом жидкостей.
Связь общего давления и состава паровой фазы с давлениями компонентов системы. Температура кипения раствора. Перегонка с водяным паром. Рас- ходный коэффициент водяного пара.
24.Ограниченная растворимость компонентов в жидком состоянии. Диаграмма с верхней критической температурой растворения, анализ диа- граммы. Определение состава критической точки полного смешения ком- понентов. Правило Алексеева.
25.Ограниченная взаимная растворимость жидкостей. Диаграмма «температура – состав» при P=const для системы с верхней критической температурой растворения. Влияние температуры на взаимную раствори- мость жидкостей. Применение правила рычага.
Химическое равновесие
1.Краткая характеристика химического равновесия. Закон действую- щих масс, термодинамическое обоснование (все реагенты – идеальные га- зы). Термодинамическая и эмпирическая константы равновесия.
2.Направление протекания химического процесса при заданных на- чальных условиях. Вывод и анализ уравнения изотермы химической реак- ции.
3.Основные количественные характеристики химического равновесия: константа химического равновесия, степень превращения, степень диссо-
20
циации, равновесный выход. Поясните смысл этих величин на примере конкретных химических реакций.
4.Степень превращения исходных веществ и равновесный выход про- дукта. Способы их расчета при заданной температуре. Какие данные необ- ходимы для этого? Дайте схему расчета любой из этих количественных ха- рактеристик химического равновесия на произвольном примере.
5.Степень превращения как количественная характеристика химиче- ского равновесия. Как повлияют повышение общего давления и темпера-
туры на степень превращения N2 в газофазной реакции синтеза аммиака? Приведите обоснование ответа и соответствующие математические выра- жения.
6.Равновесный выход химической реакции. Выразите в общем виде
константу равновесия Kp для реакции синтеза аммиака через равновесное число молей компонента (х), и общее давление в системе P, если для про-
ведения реакции исходные вещества взяты в стехиометрических количест- вах.
7.Вывод и анализ уравнения изотермы химической реакции. Химиче- ское сродство. Стандартное химическое сродство.
8.Закон действующих масс и его термодинамическое обоснование. Термодинамическая и эмпирическая константы химического равновесия. Способы выражения эмпирической константы химического равновесия.
9.Константа химического равновесия. Влияние общего давления и примеси инертного газа на равновесный выход продуктов реакции.
10.Способы выражения константы химического равновесия: Кр, Кс и Кх. Связь между эмпирическими константами равновесия.
11.Влияние температуры на химическое равновесие. Вывод и анализ уравнения изобары Вант-Гоффа.
12.Расчет тепловых эффектов химических реакций по данным о хими- ческом равновесии.
13.Влияние давления и температуры на константу химического равно- весия и смещение химического равновесия. Проиллюстрируйте на примере произвольно выбранной газофазной реакции.
14.Влияние различных факторов (Р, Т, концентрации реагентов) на смещение химического равновесия. Можно ли повышением давления до- биться увеличения выхода С3Н8 в реакции гидрирования пропена?
15.Влияние температуры на химическое сродство и константу равнове- сия газофазных реакций. Проиллюстрируйте на примере реакции гидри- рования этилена.
16.Приведите пример химической реакции, для которой константа равновесия возрастает с увеличением температуры.
17.Особенности химического равновесия в гетерогенных системах.
Примеры выражения константы химического равновесия для гетерогенных реакций.
21
18.Приведите выражение для константы равновесия двух реакций: диссоциация карбонатов кальция и магния на соответствующий оксид ме- талла и диоксид углерода. Для какой из этих реакций равновесие смещено
всторону продуктов реакции в большей степени?
19.Представьте графическую зависимость константы равновесия экзо-
термической химической реакции от температуры в координатах
lnKa=f(1/T). Поясните, как на основе указанной зависимости рассчитать средний тепловой эффект химической реакции.
20.Определение среднего и истинного теплового эффекта реакции по зависимости константы химического равновесия от температуры. Анали- тические и графические методы.
ДОМАШНИЕ ЗАДАНИЯ Основы химической термодинамики
1.160 г азота находятся при 0°С и 1,013•10 5 Н/м2. Рассчитайте теплоту изохорического увеличения давления до 1,519•10 5 Н/м2. Принять
Сv,т=С0v,298
2.Теплота реакции Mg(OH)2 = MgO + H2O, протекающей в открытом
сосуде при 400°С и давлении 101,3 кПа, равна 89,03 кДж. Как будет отли- чаться от этого значения теплота данной реакции, проводимой при той же температуре, но в закрытом сосуде?
3.Теплота растворения Na2CO3тв. при18°С равна -11,3 кДж/моль, а теп- лота гидратации этой соли при переходе в Na2CO3•7 Н2Отв. равна -58,16 кДж/моль. Определите теплоту растворения Na2CO3•7 Н2Отв.
4.Рассчитайте теплоту образования СО2 при постоянном объеме и 298°К, если известно, что при этой температуре и постоянном давлении теплота сгорания СО равна -283 кДж/моль, а теплота образования СО рав- на -110,5 кДж/моль.
5.Рассчитайте изменение энтропии изотермического испарения 0,0332
кг СВr4 при нормальном давлении, если зависимость давления насыщенно- го пара от температуры выражается уравнением lgP(Па) = 10,89 – 2665/T.
6.В результате расширения 20 кг водорода при 300°К объем газа уве- личился в 1000 раз. Вычислите изменение энергии Гиббса в этом процессе, считая водород идеальным газом.
7.Найдите изменение энтропии (Дж/К) при нагревании 1 г водяного пара при постоянном давлении от 100°С до 150°С, если удельная теплоём- кость пара при постоянном давлении Ср = 1,99 Дж/г•К.
8.Вычислите стандартное изменение энергии Гиббса реакции
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж)
при 25°С по стандартным значениям энтальпий образования и абсо- лютных энтропий, используя табличные данные.
22
4.Какими точками начинается и заканчивается кривая, выражающая зависимость давления насыщенного пара над жидкой фазой от температу- ры?
5.Уравнение Клапейрона-Клаузиуса в интегральной форме ( Hисп= const) для процесса испарения – конденсации. Определение средней тепло-
ты конденсации насыщенного пара на основании графической зависимости lgP = f(1/T).
6.Приведите уравнения, выражающие зависимость давления насыщен-
ного пара над жидкой фазой от температуры при условиях: а) H=const, б) H≠const C=const. Какому из приведенных выше условий отвечает ли- нейная зависимость в координатах lgP = f(1/T)? Пар считать идеальным
газом.
7. Охарактеризуйте фазовые поля и линии на диаграмме состояния од- нокомпонентной системы. Каким уравнением описываются все три кри- вые на диаграмме?
8.Поясните, почему тангенс угла наклона касательной к кривым воз- гонки и испарения в координатах P – T всегда положителен, тогда как к кривой плавления он может принимать значения как больше, так и мень- ше нуля?
9.Почему ряд веществ при нагревании на воздухе, минуя жидкое со- стояние, сразу переходят в пар? Проиллюстрируйте ответ анализом схема- тических диаграмм состояния, приведите примеры.
10.Плотность жидкого металла больше его плотности в твердом со- стоянии. Как изменяется температура плавления этого металла при повы- шении внешнего давления? Изобразите схематически диаграмму состоя- ния однокомпонентной системы (в координатах P – T) для рассматривае- мого случая.
11.Возрастает, уменьшается или остается неизменной энтальпия испа- рения вещества с повышением температуры? Представьте эту зависимость
в графической форме. Какое значение принимает |
энтальпия парообразо- |
вания при критической температуре? Дайте обоснованный ответ. |
|
12.Изобразите схематически график lgP = f(1/T) |
для процесса испаре- |
ния в случае, когда Hисп= const. Приведите аналитическое выражение графической зависимости. Как на основании этого графика рассчитать ве- личину средней теплоты испарения.
13.Имеются данные о зависимости давления насыщенного пара от температуры над жидкой и твердой фазами. Поясните, каким образом представив эти результаты графически в виде зависимостей ln P = f(1/T) определить координаты тройной точки?
14.Идеальные растворы. Законы Рауля и Дальтона. Взаимосвязь соста- вов паровой и жидкой фаз, диаграмма кипения для идеального раствора.
15.Запишите уравнение, выражающее правило рычага. Назовите вхо- дящие в это уравнение величины. Рассмотрите применение правила рычага
19
12.Предельно разбавленные растворы летучих компонентов. Законы Рауля и Генри, их применимость для описания зависимости давления на- сыщенного пара от состава раствора. Уравнения для химического потен- циала растворителя и растворенного вещества.
13.Следствия из закона Рауля: понижение температуры замерзания и повышение температуры кипения раствора нелетучего вещества по срав- нению с температурой замерзания (кипения) чистого растворителя (пока- зать на Р-Т-диаграмме Н2О).
14.Коллигативные свойства растворов нелетучих веществ в летучем растворителе. Взаимосвязь коллигативных свойств. Их использование для определения молярной массы растворенного вещества.
15.Криоскопия. Эбулиоскопия. Использование этих методов для опре- деления молярной массы, степени диссоциации и ассоциации растворенно- го вещества.
16.Имеются разбавленные водные растворы сульфата натрия и глице- рина с одинаковыми моляльными концентрациями. Какой из этих раство- ров будет иметь более высокую температуру начала кипения при одинако- вом внешнем давлении? Приведите объяснение.
17.Зависимость понижения температуры замерзания (отвердевания)
раствора нелетучего вещества в летучем растворителе от концентрации раствора. Криоскопическая постоянная и ее смысл. Связь криоскопиче- ской постоянной со свойствами растворителя.
18.Какую поправку необходимо внести в расчетную формулу в случае,
когда растворенное вещество присутствует в растворе в диссоциированной или ассоциированной форме?
19.Осмос. Осмотическое давление. Использование измерений осмоти- ческого давления для определения молярной массы растворенного вещест- ва.
20.Имеются два раствора одинаковой моляльной концентрации, в од- ном растворен электролит, в другом – неэлектролит. Различаются ли осмо- тические давления приведенных растворов? Дайте пояснения.
Фазовые равновесия
1.Фазовые равновесия в однокомпонентной системе, диаграмма со- стояния. Описание кривых и фигуративных точек на диаграмме. Правило фаз Гиббса.
2.Вывод и анализ уравнения Клапейрона-Клаузиуса для фазовых пере- ходов «твердая фаза – жидкость».
3.Фазовые переходы 1-го рода. Диаграмма состояния однокомпонент-
ных систем для случая, когда ρж < ρтв.. Применение правила фаз Гиббса. Какое максимальное число фаз может находиться в равновесии в одноком- понентной системе?
18
9. Определите ΔА0, G0 и S0 при испарении 1 моль воды при 100°С и давлении 1,013•10 5 Па, если удельный объём жидкой воды 1,044 м3/кг, а пара 1,673 м3/кг. Изменение энтальпии в процессе парообразования воды
2271,5кДж/кг.
10. Вычислите возрастание энтропии 1 моль Br2, взятого при темпера- туре плавления (-7,32°С), при его переходе из твердого состояния в пар при температуре кипения (61,55°С). Удельная теплоёмкость жидкого бро- ма Ср = 0,4477Дж/г•К, удельная теплота плавления равна 67,72 Дж/г, удельная теплота испарения равна 182,8 Дж/г.
Растворы
1. В 1.10-3 м3 раствора бромида натрия содержится 0,3219 кг NaBr.
Плотность |
раствора при 293 К равна 1238,2 кг/м3. |
Выразите |
концентрацию раствора: |
|
|
1)в молях соли в 1 л раствора;
2)в молях на 1 кг воды
3)в молярных долях
4)в процентах
5)в молях воды на 1 моль NaBr
2.Давление пара воды при 313 К равно 7375,4 Па. Вычислите при данной температуре давление пара раствора, содержащего 0,9206.10-2 кг глицерина в 0,36 кг воды.
3.В 0,1 кг эфира (М = 74 г/моль) содержится 0,01 кг нелетучего вещества. Давление пара этого раствора равно 426 мм рт.ст. при 293 К, а
давление пара чистого эфира при 293 К составляет 442 мм рт.ст. Рассчитайте молекулярную массу растворенного вещества.
4.Температура замерзания чистого бензола 278,5 К, температура замерзания раствора, содержащего 0,2242.10-3 кг камфоры в 3,055.10-2 кг бензола, 278,254 К. Молярное понижение температуры кристаллизации бензола 5,16°. Определите молекулярную массу камфоры.
5.В 1 кг воды растворено 0,0684 кг сахара (М = 342 г/моль). Вычислите давление пара этого раствора при 373 К. Рассчитайте температуру кипения
этого раствора, если теплота испарения воды при температуре кипения равна 2256,7.103 Дж/кг.
6.Давление водяного пара раствора, содержащего нелетучее растворенное вещество, на 2% ниже давления пара чистой воды. Определите моляльность раствора.
7.Рассчитайте осмотическое давление 0,05М раствора Na2SO4 при Т=300 К, если кажущаяся степень диссоциации соли α = 0,8.
8.Стандартное сродство G0373 химической реакции
СО + Н2О = СО2 + Н2 равно -25,6.103 Дж/моль. Определите константу равновесия этой реакции
при 373 К.
23
9. Если в сосуд вместимостью 1м3 ввести 0,03 моль водорода и 0,01 |
18. Зависимость энтропии индивидуального вещества от температуры |
|||
моль азота, то при 1000 К в нем устоновится давление 18,127.104 Па. |
при постоянном давлении. Приведите соответствующее дифференциаль- |
|||
Определите Кр и Кс реакции 3Н2 + N2 = 2NН3, |
которая будет протекать в |
ное уравнение. Схематически изобразите график этой зависимости в ши- |
||
реакционном сосуде. |
|
|
роком температурном интервале, включающем температуры плавления и |
|
10. Константа равновесия реакции Н2 + I2 = 2HI при 633 К равна 61.6, а |
кипения вещества. |
|||
при 718 К она равна 41,7. Рассчитайте среднее значение теплового эффекта |
19. Энергия Гиббса, зависимость энергии Гиббса от температуры и |
|||
реакции и химическое сродство при 718 К. Вычислите изменение |
давления. Графическое представление и анализ указанных зависимостей. |
|||
энтропии. |
|
|
20. Энергия Гельмгольца. Зависимость энергии Гельмгольца от ее есте- |
|
|
|
|
ственных переменных (V и T). Графическое представление указанных за- |
|
Фазовые равновесия |
|
висимостей. Энтропия, энергия Гиббса и энергия Гельмгольца как крите- |
||
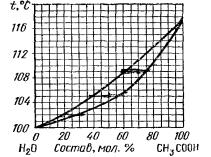
1.1. Укажите температуры начала и конца |
конденсации системы, со- |
рии состояния равновесия и направления процессов. |
||
|
||||
держащей 80% Н20 (рис. 1). Каков состав первых капель жидкости в нача- |
Растворы |
|||
ле конденсации? |
|
|
||
|
|
|
||
1.2. Какие фазы и какого состава находятся в равновесии, если система, |
1. Парциальные молярные свойства компонентов системы, определение |
|||
состоящая из 2 моль СНзСООН и 2 моль Н20, нагрета до 105°С (рис. 1)? |
и математическое выражение. Аналитические и графические методы опре- |
|||
1.3. Как изменится состав пара над жидкостью, содержащей 20% Н20, |
деления парциальных молярных величин. |
|||
если к ней добавить некоторое количество СНзСООН (рис. 1)? |
2. Парциальные молярные величины компонентов раствора. Вывод и |
|||
1.4. Сколько степеней свободы имеет система, содержащая 100% |
анализ уравнений Гиббса-Дюгема. |
|||
СНзСООН при 118°С? Какие параметры состояния можно менять, не на- |
3. Термодинамические функции смешения при образовании растворов |
|||
рушая фазового равновесия в этой системе (рис. 1)? |
из чистых компонентов. Вывод уравнения, устанавливающего связь тер- |
|||
1.5. Вычислите в массовых процентах состав раствора (рис. 1), который |
модинамических функций смешения с относительными парциальными мо- |
|||
начинает кипеть при 106° С. |
|
|
лярными свойствами компонентов раствора. |
|
1.6. Нагреты до 107°С 15 моль парожидкостной смеси, общий состав |
4. Идеальные растворы. Зависимость давления насыщенного пара от |
|||
которой 55 мол.% СН3СООН и 45 мол.% Н20 (рис. 1). Определите, сколько |
состава раствора, закон Рауля. Термодинамическое обоснование закона |
|||
граммов уксусной кислоты будет содержаться в жидкости при этой тем- |
Рауля. |
|||
пературе. |
|
|
5. Закон Рауля, графическая интерпретация. Положительные и отрица- |
|
|
|
|
тельные отклонения от закона Рауля. |
|
|
|
|
6. Дайте определение идеального раствора. Приведите примеры систем, |
|
|
|
|
представляющих практически идеальный раствор в жидкой фазе. |
|
|
|
|
7. Неидеальные растворы. Активность и коэффициент активности ком- |
|
|
|
|
понента раствора. Термодинамические функции смешения при образова- |
|
|
|
|
нии неидеальных растворов из чистых компонентов. |
|
|
|
|
8. Экспериментальное определение коэффициента активности компо- |
|
|
|
|
нента раствора по величине давления его насыщенного пара. |
|
|
|
|
9. Выбор стандартного состояния. Симметричная и несимметричная |
|
|
|
|
системы сравнения. Методы определения активности. |
|
Рис. 1. Диаграмма кипения системы СН3СООН – Н2О |
10. Отклонения от закона Рауля. Химический потенциал, активность, |
|||
коэффициент активности в разных системах стандартных состояний. Экс- |
||||
|
|
|
||
2.1. По диаграмме плавкости (рис. 2) сделайте |
заключение, изоморфно |
периментальные методы определения активности и коэффициента актив- |
||
ности. |
||||
или неизоморфно кристаллизуются компоненты |
А и В. Уточните ответ, |
|||
11. Взаимосвязь парциальных молярных величин компонентов бинар- |
||||
указав диапазон концентраций. |
|
|
||
|
|
ного раствора. Вывод и анализ 2-ого уравнения Гиббса-Дюгема. |
||
|
|
|
||
24 |
|
|
17 |
|

го изобарного расширения идеального двухатомного газа от одного и того же начального состояния до двукратного увеличения объёма. Поясните для какого из указанных выше процессов работа расширения больше?
5.Изохорная и изобарная молярные теплоемкости. Связь между ними для идеального газа. Зависимость изобарной теплоемкости от температуры для веществ в кристаллическом, жидком и газообразном состоянии.
6.Внутренняя энергия и энтальпия системы, их взаимосвязь. Зависи- мость внутренней энергии и энтальпии вещества от температуры. Интег- рирование соответствующих уравнений.
7.Термохимия. Закон Гесса и его термодинамическое обоснование.
Связь тепловых эффектов химической реакции при постоянном давлении и постоянном объеме.
8.Тепловой эффект химической реакции. Стандартные теплоты обра- зования и сгорания. Закон Гесса, следствия из закона Гесса.
9.Стандартные теплоты образования и сгорания химических соедине- ний. Их использование для расчета тепловых эффектов химических про- цессов. Как на основании экспериментальной величины стандартной теп- лоты сгорания какого-либо вещества рассчитать стандартную теплоту его образования? Какие дополнительные сведения необходимы для этого?
10.Тепловой эффект химической реакции как функция температуры, уравнение Кирхгофа.
11.Вывод и анализ уравнения Кирхгофа. Использование интегральных форм уравнения для вычисления тепловых эффектов химических процес- сов при заданной температуре (в том числе стандартной теплоты образо- вания при T≠298°).
12.Второе начало термодинамики. Энтропия, изменение энтропии в термодинамических процессах с участием идеального газа при P=const и T=const.
13.Зависимость энтропии от температуры и давления. Изменение эн- тропии в процессах с участием идеального газа.
14.Самопроизвольные и несамопроизвольные процессы. Второе нача- ло термодинамики. Математическое выражение 2-го закона термодинами- ки. Изменение энтропии в самопроизвольном процессе, протекающем в изолированной системе.
15.Второе начало термодинамики, математическое выражение для об- ратимых и необратимых (самопроизвольных) процессов. Энтропия как критерий равновесия и направления самопроизвольного протекания про- цесса в изолированной системе.
16.Объединенное уравнение I и II законов термодинамики. Энергия Гиббса и энергия Гельмгольца как критерии состояния равновесия и на- правления химического процесса.
17.Постулат Планка. Аналитический и графический методы определе- ния абсолютной стандартной энтропии вещества.
16
2.2.Какие фазы находятся в равновесии в условиях, обозначенных точ-
ками 1, 2, 3,4 и 5 на рис. 2?
2.3.Система в твердом состоянии, содержащая 4 моль В и 6 моль А, на- гревается от 100 до 600° С (рис. 2). Укажите, при каких температурах сис- тема гомогенна.
2.4.Система, содержащая 80% А, нагревается, начиная с 100° С (рис. 2). Укажите температуры начала и конца плавления, а также состав первых капель жидкости. При каком содержании компонента А (%) система имеет наиболее низкую температуру плавления?
2.5.Нарисуйте в координатах температура – время общий вид кривой охлаждения для системы, содержащей 80 мол.°/о В (рис. 2), в температур- ном интервале от 500 до 100° С. Отметьте наиболее характерные точки.
2.6.Определите, какой компонент и в каком количестве выделится в твердом состоянии при охлаждении 0,500 кг смеси, содержащей 80 мол.%
В(рис. 2), от 400 до 250° С; МA=100 г/моль; МB= 120 г/моль.
Рис. 2. Диаграмма плавкости двухкомпонентной системы
3. По характерным точкам на кривых охлаждения вычертить диаграмму плавкости системы медь – никель:
Ni, % |
0 |
20 |
40 |
60 |
80 |
100 |
Т начала кристаллизации, |
1373 |
1467 |
1554 |
1627 |
1683 |
1728 |
К |
|
|
|
|
|
|
Т конца кристаллизации, К |
1373 |
1406 |
1467 |
1543 |
1629 |
1728 |
На диаграмме плавкости обозначьте точками:
а – чистую твердую медь в равновесии с расплавом меди;
б – жидкий расплав, содержащий 45% Ni в равновесии с твердым рас- твором;
в – твердый раствор, содержащий 65% Ni в равновесии с жидким рас- плавом;
г – жидкий расплав, содержащий 50% Ni при температуре 1670 К.
25

Определите для системы, содержащей 30% Ni, температуру начала кристаллизации, состав первого кристалла твердого раствора, массу Ni в жидком и твердом состояниях при охлаждении 0,24 кг смеси, содержащей 30% Ni, до 1470 К; температуру кристаллизации последней капли жидкого расплава, состав последней капли жидкого расплава.
4. По характерным точкам на кривых охлаждения постройте диаграмму плавкости для системы хлорид серебра – хлорид калия:
AgC1, % |
0 |
20 |
40 |
60 |
80 |
100 |
Т начала кристаллизации, К |
1055 |
958 |
837 |
688 |
630,6 |
728 |
Т конца кристаллизации, К |
1055 |
584 |
584 |
584 |
584 |
728 |
Сколько хлорида калия надо добавить к 1,7 кг хлорида серебра, чтобы понизить температуру начала плавления до 650 К?
Укажите на диаграмме плавкости области, для которых число степе- ней свободы равно 2, 1 и 0.
5. По диаграмме плавкости системы серебро – медь определите, в ка- ком фазовом состоянии находятся системы, обозначенные на рис. 3 точ-
ками а, б, в, г, д, е, ж, з.
Рис. 3. Диаграмма плавкости системы Ag – Cu
РАСЧЕТНЫЕ ЗАДАЧИ Основы химической термодинамики
1. При полном окислении метана при 25°С и постоянном объеме обра- зовалось 18 г жидкой воды и выделилось 442.68 кДж теплоты. Вычислите СН° (298 К), fH° (298 К), fН° (50°С) для метана, если энтальпии образо- вания С02 и Н20(ж) при 298 К составляют -393.51 и -285.83 кДж/моль соот- ветственно. Недостающие данные взять из справочника (или спросить у
преподавателя).
26
Различные виды диаграмм состояния. Азеотропные смеси и их свойства. Законы Гиббса–Коновалова.
Равновесие «жидкость – твердое вещество» в бинарных системах. Пра- вило Гиббса – Розебума. Системы с образованием эвтектики, твердые растворы, с конгруэнтно и инконгруэнтно плавящимися химическими со- единениями. Трехкомпонентные системы. Треугольники Гиббса и Розе- бума. Дальтониды и бертоллиды.
Химическое и адсорбционное равновесие
Различные виды констант равновесия и связь между ними. Химическая переменная. Химическое равновесие в идеальных и неидеальных системах. Термодинамический вывод закона действия масс.
Изотерма Вант-Гоффа. Изменение энергии Гиббса и энергии Гельм- гольца при химической реакции. Термодинамическая трактовка понятия о химическом сродстве. Расчеты констант равновесия химических реакций с использованием таблиц стандартных значений термодинамических функ- ций. Приведенная энергия Гиббса и ее использование для расчетов хими- ческих равновесий. Расчеты выхода продуктов химических реакций раз- личных типов. Выходы продуктов при совместном протекании нескольких химических реакций.
Зависимость констант равновесия от температуры. Уравнения изобары и изохоры реакции, их термодинамический вывод. Использование различ-
ных приближений для теплоемкостей реагентов при расчетах химических равновесий при различных температурах.
Контрольные вопросы Основы химической термодинамики
1.Основные понятия химической термодинамики. Система, равновес- ное состояние и термодинамический процесс. Экстенсивные и интенсив- ные свойства. Функции состояния и функции процесса. Может ли термо- динамическая величина, являющаяся, в общем случае, функцией процесса, приобретать свойства функции состояния? При положительном ответе приведите примеры.
2.Первое начало термодинамики. Внутренняя энергия. Теплота и рабо- та как формы передачи энергии. Взаимосвязь этих величин в изохорном и изотермическом процессах.
3.Первый закон термодинамики, формулировки 1-го закона термоди- намики. Внутренняя энергия системы. Теплота и работа как формы пере- дачи энергии. 1-ый закон термодинамики применительно к изотермиче- скому и изохорному процессам.
4.Изобразите схематически на одном графике в координатах парамет- ров состояния Р= f(V) процессы обратимого изотермического и обратимо-
15
газов. Изменение энтропии при необратимых процессах. Неравенство Клаузиуса. Некомпенсированная теплота и «потерянная работа». Обосно- вания второго закона термодинамики. Коэффициент полезного действия тепловой машины. Определение энтропии по Клаузиусу. Постулат План- ка и область его применимости. Свойства тел вблизи абсолютного нуля. Абсолютные значения энтропии. Статистическое определение энтропии.
Характеристические функции, их определение и свойства. Энергии Гельмгольца и Гиббса как характеристические функции. Условия равнове- сия и экстремумы характеристических функций. Уравнение Гиббса– Гельмгольца.
Химический потенциал. Его определение через производные от раз- личных термодинамических функций и вычисление для идеального газа. Летучесть и ее вычисление для реальных газов. Использование летучести для определения химического потенциала реальных газов. Равновесие в поле внешних сил.
Растворы. Фазовые равновесия
Растворы в различных агрегатных состояниях. Единицы концентрации. Смеси идеальных газов и свойства идеальных газовых растворов. Энтро- пия и энергия Гиббса для смеси идеальных газов.
Общее определение идеальных растворов в любых агрегатных состоя- ниях. Коллигативные свойства растворов. Эмпирические законы Рауля для давления пара, криоскопических и эбуллиоскопических эффектов и Вант- Гоффа для осмотического давления. Их термодинамический вывод.
Неидеальные растворы и их термодинамическое описание. Метод ак- тивностей Льюиса. Вычисление коэффициентов активностей по давлению пара компонентов раствора, по данным криоскопии и осмотическому дав- лению (для растворов не электролитов). Осмотический коэффициент рас- творителя и его опытное определение. Стандартные состояния для хими- ческого потенциала. Симметричная и несимметричная системы отсчета.
Термодинамическая классификация растворов. Атермальные, регуляр- ные растворы и их свойства. Предельно разбавленные растворы. Эмпири- ческие закономерности для коэффициентов активности.
Парциальные мольные величины и их определение из опытных данных. Уравнения Гиббса–Дюгема. Взаимосвязи парциальных мольных величин, вытекающие из уравнения Гиббса–Дюгема (на примере парциальных мольных объемов бинарного раствора H2O–C2H5OH).
Правило фаз Гиббса. Определение фазы, компонента, числа степеней свободы. Вывод правила фаз и его применение для описания однокомпо- нентных систем на примере диаграмм состояния фосфора и воды в широ- ком диапазоне давлений. Монотропия и энантиотропия.
Равновесие «жидкость – пар» в двухкомпонентных системах. Взаимо- связь составов пара и жидкости для идеальных и неидеальных растворов.
14
2. В равновесном процессе при постоянной температуре 27°С происхо- дит сжатие 42 г азота от объема 2V1 до V1. Рассчитайте A, Q, U, ΔН, S,
G и F в процессе. Считайте что азот – идеальный газ.
3. При полном сгорании 0.6 моля твердого глицина (NH2CH2COOH) (с образованием жидкой воды, углекислого газа и газообразного азота) в ка- лориметрической бомбе (V = const) выделилось 581.9 кДж теплоты (про- веден пересчет к 298 К и парциальным давлениям компонентов 1 атм).
Рассчитайте: а) стандартную энтальпию реакции окисления глицина при 298 К,
б) стандартную энтальпию образования NH2CH2COOH при 298 К (ука- жите, какую реакцию характеризует эта величина), если известны энталь-
пия испарения воды при 298 К |
VH°298 = 44 кДж /моль и стандартные эн- |
||||||
тальпии реакций: |
|
|
|
|
|
||
|
Н20(г) -> Н2 + 0.502 ГH°298 = 241.8 кДж/моль |
|
|
||||
С(графит) + 02 —> С02 |
rН°298 = -393.5 кДж/моль. |
|
|||||
4. Используя данные таблицы, рассчитайте значения стандартных тер- |
|||||||
модинамических функций rF° и |
rG° при 1000 К для реакции |
|
|||||
|
|
2АС(Г) + 2 В(г) —> 2С(Г) + А2В2(ТВ) |
|
|
|||
|
|
|
|
|
|
|
|
|
|
fH° 298 |
|
S°298, Дж/моль |
|
Cp Дж/моль-К |
|
Вещество |
|
кДж/моль |
|
.К |
|
|
|
В(Г) |
|
|
0 |
11.0 |
|
3 |
+ 0.003T |
АС(Г) |
|
|
-50 |
26.5 |
|
5 |
+ 0.002T |
С(Г) |
|
|
0 |
9.1 |
|
4 |
+ 0.001 Т |
А2В2(ТВ) |
|
|
-110 |
9.5 |
|
6 |
|
5. Оцените энергию Гиббса реакции
С02 + 4Н2 = СН4 + 2Н20(ж)
при 298 К и парциальных давлениях газообразных веществ, равных 2 атм, если rG°(298 К) = -31.2 ккал/моль. Считайте, что газообразные уча- стники реакции – идеальные газы, а объемом жидкой фазы можно пренеб- речь.
6. 4 г идеального газа, взятого при давлении 2 атм и температуре 25°С, подвергли адиабатическому обратимому расширению до 1 атм. Определи- те конечную температуру и объем газа, A, Q, U и S процесса для двух случаев: а) газ – водород; б) газ – гелий.
7.Сколько тепла потребуется на перевода 500 г А1 (т.пл. 658°С, ΔН° =
92.4кал/г), взятого при комнатной температуре, в расплавленное состоя-
ние, если Ср(А1(т)) = 0.183 + 1.096 .10-4 T кал/г. К?
8.Стандартная энтальпия реакции СаС03(тв) = СаО(тв) + С02(г), проте- кающей в открытом сосуде при температуре 1000 К, равна 169 кДж/.моль. Чему равна теплота этой реакции, протекающей при той же температуре, но в закрытом сосуде?
27
9.Рассчитайте стандартную внутреннюю энергию образования жидко- го бензола при 298 К, если стандартная энтальпия его образования равна 49,0 кДж/моль.
10.Рассчитайте энтальпию образования N205(r) при Т = 298 К на осно- вании следующих данных:
2NO (г) + 02(Г) = 2N02(г), |
H1° = -114.2 кДж/моль, |
|
4N02(г) + 02(г) = 2N205(г), |
ΔН2° = -110.2 |
кДж/моль, |
N2(г) + 02(г) = 2NO (г) , |
H 3° = 182.6 |
кДж/моль. |
11. Энтальпии сгорания α-глюкозы, β-фруктозы и сахарозы при 25° С равны -2802, -2810 и -5644 кДж/моль, соответственно. Рассчитайте теп- лоту гидролиза сахарозы.
12. Рассчитайте теплоту образования сульфата цинка из простых ве- ществ при Т = 298 К на основании следующих данных:
ZnS = Zn + S, |
ΔН1° = 200.5 кДж/моль, |
2ZnS + 302 = 2ZnO + 2S02, |
H2° = -893.5 кДж, |
2S02 + 02 = 2S03, |
H3° = -198.2 кДж |
ZnS04 = ZnO + S03, |
H4° = 235.0 кДж/моль |
13. Приведите пример термодинамического процесса, который может быть проведен как обратимо, так и необратимо. Рассчитайте изменение эн- тропии системы и окружающей среды в обоих случаях.
14. Рассчитайте мольную энтропию неона при 500 К, если при 298 К и
том же объеме энтропия неона равна 146,2 Дж* |
* |
|
. |
|
15. Рассчитайте изменение энтропии при |
нагревании 11,2 л азота 0 до |
|||
моль |
|
К |
|
|
С и одновременном уменьшении давления от 1 атм до 0,1 атм. |
|
|
|
|
|||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 16. Один моль гелия при 10 С и 1 атм смешивают с 0,5 моль неона |
|||||||||||||||||
при С и 1 атм. Определите |
изменение энтропии, если конечное давление |
||||||||||||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
равно 1 атм. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17. Рассчитайте изменение энтропии при образовании 1 |
|
воздуха из |
|||||||||||||||
азота и кислорода (20 об.%) при температуре 2 |
|
С и |
давлении 1 атм. |
|
|
|
|||||||||||
|
|
|
м |
|
|
* |
|
), |
|||||||||
18. Три моля идеального одноатомного |
газа ( =3,0 кал*мол |
|
|
||||||||||||||
|
5 |
|
|
адиабатически рас- |
|||||||||||||
находящегося при |
|
=350°К и |
|
=5,0 атм, обратимо и |
|
|
|
ь |
|
К |
|
||||||
ширяются до |
давления =1,0 атм. Рассчитайте конечные температуру и |
||||||||||||||||
|
Т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
объем, а также совершенную работу и изменение внутренней энергии, эн- тальпии и энтропии в этом процессе.
19. Рассчитайте изменение энтропии при нагревании 0,4 моль хлорида
натрия от 20 до 85 С. Мольная теплоемкость хлорида натрия равна: |
|||||||||||||
С |
(NaCΙ(тв)) = 66,53 Дж*мол |
0 |
* |
|
. |
ь |
* |
К |
, |
||||
|
(NaC |
|
) = |
45,94+16,32*1 |
|
ТДж*мол |
|
|
|||||
|
|
0 |
|
|
|
|
|
|
|
|
|
||
31,0Температура плавления |
|
|
|
|
|
|
|
|
|
||||
|
|
ь |
|
хлорида |
натрия |
|
|
|
|||||
С |
|
Ι(ж) |
|
|
|
ь |
|
К |
|
|
800°С, теплота плавления |
||
кДж*мол .
28
|
онные равно- |
|
г) Тест |
2 |
2 |
|
весия |
|
д) Выполнение письменного домашне- |
3 |
4 |
|
|
|
го задания |
||
|
|
|
|
|
|
|
|
|
е) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Определение адсорб- |
|
|
|
|
|
ционной емкости активированного угля |
1 |
1,5 |
|
|
|
при очистке воды от органических |
|
|
|
|
|
примесей» |
|
|
|
|
|
ж) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Изучение процессов |
1 |
1,5 |
|
|
|
сорбции ионов металлов на ионооб- |
||
|
|
|
|
|
|
|
|
|
менных смолах» |
|
|
|
|
3 контрольная точка |
40 |
60 |
|
Промежуточная аттестация – экзамен |
21 |
40 |
|||
ВСЕГО ЗА СЕМЕСТР |
61 |
100 |
|||
ВОПРОСЫ КОЛЛОКВИУМОВ Основы химической термодинамики
Термодинамическая система, термодинамические переменные, термо- динамические процессы. Теплота и работа. Функции состояния. Уравнения состояния идеальных и реальных газов. Уравнение Ван-дер-Ваальса и его анализ.
Первый закон термодинамики. Его формулировка и запись в диффе- ренциальной и интегральной формах. Энтальпия как функция состояния. Вычисление работы для различных процессов в газах. Взаимные превра- щения теплоты и работы.
Калорические коэффициенты. Их определение и вычисление. Теплоты различных процессов. Теплоемкости. Их определение в общей физике и термодинамике. Эмпирические уравнения для зависимости теплоемкостей от температуры.
Термохимия. Теплоты химических реакций. Термохимические уравне- ния. Закон Гесса. Его формулировки и вывод из первого начала термоди- намики для закрытых систем. Связь QP и QV. Теплоты сгорания и теплоты образования. Их использование для расчета тепловых эффектов химиче- ских реакций. Расчеты тепловых эффектов реакций путем комбинирова- ния термохимических уравнений. Стандартное состояние и стандартные теплоты химических реакций. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной формах.
Второй закон термодинамики, его различные формулировки и их взаи- мосвязь. Изменение энтропии при различных обратимых процессах и вы- числение энтропии из опытных данных. Вычисление энтропии идеальных
13
|
|
торной работы «Калориметрическое |
|
|
|
|
|
определение энтальпии растворения |
|
|
|
|
|
соли в воде» |
|
|
|
|
|
е) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Оценка атомной тепло- |
1 |
2 |
|
|
|
емкости простых веществ. Проверка |
|||
|
|
|
|
||
|
|
правила Дюлонга и Пти» |
|
|
|
|
|
1 контрольная точка |
12 |
20 |
|
|
|
а) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Определение раство- |
1 |
1,5 |
|
|
|
римости и произведения растворимости |
|||
|
|
|
|
||
|
|
малорастворимой соли» |
|
|
|
|
|
б) Коллоквиум по теме «Растворы. Фа- |
4 |
6 |
|
|
|
зовые равновесия» |
|||
|
|
|
|
||
|
|
в) Выполнение письменного домашнего |
3 |
5 |
|
|
|
задания |
|||
|
|
|
|
||
|
|
г) Тест |
2 |
2 |
|
|
|
д) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Определение констан- |
1 |
1,5 |
|
|
|
ты и степени диссоциации слабого |
|||
|
|
|
|
||
|
|
электролита методом потенциометрии» |
|
|
|
|
Растворы. |
е) Выполнение и оформление лабора- |
|
|
|
|
торной работы «Определение водород- |
|
|
||
2. |
Фазовые пре- |
ного показателя (рН) и изучение влия- |
1 |
1,5 |
|
|
вращения. |
ния разбавления на величину рН бу- |
|||
|
|
|
|||
|
|
ферных растворов потенциометриче- |
|
|
|
|
|
ским методом» |
|
|
|
|
|
ж) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Кондуктометрическое |
1 |
1.5 |
|
|
|
титрование» |
|
|
|
|
|
з) Определение константы и степени |
|
|
|
|
|
диссоциации слабого электролита кон- |
1 |
1 |
|
|
|
дуктометрическим методом |
|
|
|
|
|
2 контрольная точка |
26 |
40 |
|
|
|
а) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Изучение фазовых диа- |
1,5 |
2 |
|
|
|
грамм двухкомпонентных систем» |
|
|
|
|
|
б) Выполнение и оформление лабора- |
|
|
|
|
|
торной работы «Изучение равновесия |
1,5 |
2 |
|
|
|
гомогенной реакции в растворе» |
|
|
|
|
Химические |
в) Коллоквиум по теме «Химическое |
3 |
5 |
|
3. |
и адсорбци- |
равновесие» |
|||
|
|
||||
|
|
12 |
|
|
|
|
20. |
Рассчитайте изменение энтропии при смешении 5 кг воды при 80°С |
|||||
и |
10 |
кг воды при 2 |
С. Удельную теплоемкость воды принять равной: |
|||||
С |
( |
|
О)=4,184 Дж* |
|
0 * |
|
. |
|
|
21. |
Рассчитайте изменение энтропии при добавлении 200 г льда, нахо- |
||||||
|
Н |
|
|
г |
|
К |
|
|
дящегося при температуре 0°С, к 200 г водыь (90°) в изолированном сосуде. Теплота плавления льда равна 6,0 кДж*мол .
22.Запишите выражение для расчета абсолютной энтропии одного мо- ля воды при температуре 300°С и давлении 2 атм.
Газ, расширяясь от 10 до 16 л при постоянном давлении 101.3 кПа, по- глощает 126 Дж теплоты. Определите изменение внутренней энергии газа.
23.Определите изменение внутренней энергии, количество теплоты и
работу, совершаемую при обратимом изотермическом расширении азота от 0.5 до 4 м3 (начальные условия: температура 26.8°С, давление 93.2 кПа).
24.Один моль идеального газа, взятого при 25°С и 100 атм, расширяет- ся обратимо и изотермически до 5 атм. Рассчитайте работу, поглощенную теплоту, U и ΔН.
25.Рассчитайте изменение энтальпии кислорода (идеальный газ) при изобарном расширении от 80 до 200 л при нормальном атмосферном дав- лении.
26.Какое количество теплоты необходимо для повышения тем- пературы 16 г кислорода от 300° до 500° К при давлении 1 атм? Как при этом изменится внутренняя энергия?
27.Один моль ксенона, находящийся при 25°С и 2 атм, расширяется адиабатически: а) обратимо до 1 атм, б) против давления 1 атм. Какой бу- дет конечная температура в каждом случае?
28.Рассчитайте изменение внутренней энергии гелия (одноатомный газ) при изобарном расширении от 5 до 10 литров под давлением 196 кПа.
Растворы
1.Определите относительное понижение давления пара для раствора, содержащего 0,01 моль нелетучего растворенного вещества в 0,5 кг воды.
2.Давление пара воды при 313 К равно 7375,4 Па. Вычислите при дан- ной температуре давление пара раствора, содержащего 0,9206*10 -3 кг гли- церина в 0,360 кг воды.
3.Вычислите данные пара эфира на 3%-ным раствором анилина в эти-
ловом эфире (C2H5)2O при 293 К. Давление пара эфира при этой темпера- туре равна 5,89*104 Па.
4.Давление пара серного эфира при 293 К равно 0,589*105 Па, а давле-
ние пара раствора, содержащего 0,0061 кг бензойной кислоты в 0,05 кг эфира при той же температуре, равно 0,548*105 Па. Рассчитайте молеку-
лярную массу бензойной кислоты в эфире и относительную ошибку опыта
29

в процентах по сравнению с величиной, приведенной в справочных табли- цах.
5.Водный 7,5%-ный раствор хлорида кальция кипит при нормальном атмосферном давлении 1,0133*105 Па и 374 К. Вычислите коэффициент i. Давление пара воды при 374 К равно 1,05*105 Па.
6.Определите процентную концентрацию водного раствора глицерина, если давление пара этого раствора равно давлению пара раствора, содер-
жащего 0,0089 г кг NaNO3 в 1 кг воды. Кажущаяся степень диссоциации NaNO3 в указанном растворе воды 64,9%.
7.Давление пара раствора, содержащего 2,21*10 -3 кг CaCl2 и 0,1 кг во- ды при К, равно 2319,8 Па, а давление пара воды при той же температуре 2338,5 Па. Вычислите кажущуюся молекулярную массу и кажущуюся сте- пень диссоциации CaCl2.
8.В 0,1 кг эфира (М = 74) содержится 0,01 кг нелетучего вещества.
Давление пара этого раствора равно 426 мм рт. ст. при 293 К, а давление пара чистого эфира при 293 К -442 мм рт. ст. рассчитайте молекулярную массу растворенного вещества.
9.В 1 кг воды растворено 0,0684 кг сахара (М= 342). Вычислите дав- ление пара этого раствора при 373 К. рассчитайте температуру кипения
его, если теплота испарения воды при температуре кипения равно
2256,7*103Дж/кг.
10.Температура кипения бензола 353,36 К. Его молярные теплота ис- парения при температуре кипения 30795 Дж/моль. Определите эбулиоско- пическую константу бензола.
11.Температура кипения чистого CS2 319,2° К. Раствор, содержащий
0,217*10-3 кг серы в 1,918*10-2 кг CS2; кипит при 319,304°К, Эбулиоскопи-
ческая константа сероуглерода 2,37°С. Определите число атомов, которые содержится в молекуле серы, растворенной в сероуглероде, если атомная масса серы 32.
12.В 0,0106 кг раствора содержится 0,40*10-3 кг салициловой кислоты,
растворенной в этиловом спирте. Этот раствор кипит при температуре на 0,337о выше чистого спирта. Молекулярное повышение температуры ки- пения этилового спирта 1,19о. Определите молекулярную массу салицило- вой кислоты.
13.Чистая вода кипит при 373,2°К и атмосферном давлении. Опреде- лите температуру кипения раствора, содержащего 3,291*10-3 кг хлорида
кальция в 0,1 кг воды. Кажущаяся степень диссоциации CaCl2 в указанном растворе 68%. Эбулиоскопическая константа для воды 0,516°.
14.Определите кажущуюся степень диссоциации HIO3 в растворе со- держащим 0,506*10 -3 кг HIO3 в22,48*10 -3кг этилового спирта. Раствор ки- пит при 351,624 К, чистый этиловый спирт кипит при 351,46 К. Молярное повышение температуры кипения спирта 1,19о.
30
-тестирование;
-письменные домашние задания;
-отчет по лабораторной работе.
Выполненные домашние задания представляются в письменном виде.
Каждое домашнее задание содержит теоретические вопросы и расчетные задачи. Критерий оценивания домашних заданий каждой темы – от 3 до 5 баллов. Каждый вопрос соответственно оценивается в пределах 0,5 – 1 балл в зависимости от темы и количества заданий.
Отчет по лабораторной работе представляется в письменном виде. За- щита отчета проходит в форме ответов на вопросы преподавателя. В слу- чае, если оформление отчета и поведение студента во время защиты соот- ветствуют требованиям, студент получает максимальное количество бал- лов.
Основаниями для снижения количества баллов в диапазоне от «max» до «min» являются:
§небрежное выполнение,
§неполное оформление опыта;
§отсутствие вывода и т.д.
Каждая лабораторная работа оценивается в пределах 0,5 – 2 |
балла, |
в зави- |
|||||
симости от сложности и трудоемкости. |
|
|
|
||||
|
Промежуточный |
контроль знаний проводится в конце каждого се- |
|||||
местра в виде экзамена. |
|
|
|
||||
|
На экзамене студент набирает от 21 до 40 баллов. Оценка по экзамену |
||||||
выставляется в соответствии со следующей шкалой: |
|
|
|
||||
|
|
|
|
36-40 баллов – «отлично» |
|
|
|
|
|
|
|
30-35 баллов – «хорошо» |
|
|
|
|
|
|
|
21-29 баллов – «удовлетворительно» |
|
||
|
|
|
|
менее 21 балла – «неудовлетворительно» |
|
||
|
|
|
|
|
|
|
|
|
|
Тема по дис- |
Виды учебных поручений и формы |
|
Баллы |
||
|
|
циплине |
|
контроля |
|
Мин. |
Макс. |
|
|
|
|
а) Коллоквиум по теме «Основы хи- |
|
4 |
6 |
|
|
|
|
мической термодинамики» |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
б) Выполнение письменного домашне- |
|
3 |
5 |
|
|
|
|
го задания |
|
||
|
|
Основы хи- |
|
|
|
|
|
|
|
|
в) Тест |
|
2 |
3 |
|
1. |
|
мической |
|
|
|||
|
|
г) Выполнение и оформление лабора- |
|
|
|
||
|
|
термодина- |
|
торной работы «Калориметрическое |
|
|
|
|
|
мики |
|
|
|
|
|
|
|
|
определение молярной теплоты ней- |
|
1 |
2 |
|
|
|
|
|
|
|||
|
|
|
|
трализации и определение концентра- |
|
|
|
|
|
|
|
ции кислоты по тепловому эффекту» |
|
|
|
|
|
|
|
д) Выполнение и оформление лабора- |
|
1 |
2 |
|
|
|
|
11 |
|
|
|
