
Test_obmen_belkov
.docxКоферментом трансаминаз является :
Пиридоксальфосфат
Из каких соединений образуется активный карамоилфосфат в орнитиновом цикле:
Вода
Углекислый газ
Аммиак
Какие органы участвуют в синтезе креатина
Почки
Печень
Какая рН нормального желудочного сока?
1.5-2.0
Глико-кетогенный является аминокислота
Фенилаланин
Какие функции выполняет Gln?
Является донором амидной группы для биосинтеза
Является транспортной формой аммиака
Условно заменимой аминокислотой является
Цистеин
Какие ферменты отщепляют С-концевые аминокислоты при расщеплении белков
Карбоксипептидазы
Как происходит активация пепсиногена
Соляной кислотой
Аутокаталитически
Какая из перечисленных реакций, происходящих с аминокислотами, дает биогенные амины?
Декарбоксилирование
Какая аминокислота необходима для биосинтеза глутатиона
Цистеин
Что происходит при трансаминировании аминокислот
Межмолекулярный перенос аминогруппы
При превращении аргинина в цитруллин выделяется
Оксид азота
Какой биогенный амин является предшественником норадреналина и адреналина?
Дофамин
В каких процессах участвуют безазотистые остатки аминокислот после дезаминирования?
Синтез заменимых аминокислот
Окисление до СО2 и Н2О
Синтез глюкозы
Частично заменимой аминокислотой является?
Аргинин
Какие ферменты участвуют в прямом дезаминировании аминокислот?
L-оксидазы
Для прямого дезаимнирования аминокислот характерно
Участвуют оксидазы
Коферментом трансаминаз является производное витамина
В6
Оптимальной рН для трипсина является
рН 7-8
Какая аминокислота является акцепторами аммиака в момент его образования в клетке
Глутамат
Незаменимой аминокислотой является
Лейцин (Валин)
Какие вещества необходимы для синтеза гема?
Сукцинил- СоА
Глицин
Как изменяется концентрация мочевины в сыворотке у больных с тяжелыми заболеваниями печени?
Понижается
Аммиак в организме образуется в результате процессов
Дезаминирования аминокислот
Дезаминирования АМФ
Обезвреживание биогенных аминов окислительным путем
N-концевые пептидные связи в белке расщепляет
Аминопептидаза
Общим метаболитом цикла трикарбоновых кислот и орнитинового цикла является
Фумарат
Условно заменимой аминокислотой является
Цистеин
Симптомами гиперамониемии являются тошнота, рвота, головокружение, судороги, потеря сознания. Что вызывает эти симптомы?
Действие аммиака на мозг
Какие конечные продукты образуются при конечном окислении аминокислот
Вода
Аммиак
Углекислый газ
Какой биогенный амин образуется при декарбоксилировании Glu?
Гамма-аминомасляная кислота
Непрямое дезаминирование аминокислот в печени включает последовательно реакции
Переаминирование, дезаминирование Glu
Гликогенной является аминокислота
Аланин
Соляная кислота желудочного сока
Денатурирует белки пищи
Создает оптимум рН для действия пепсина
Вызывает частичный протеолиз пепсиногена
Реакции метилирования в организме осуществляются с помощью аминокислоты
Метионин
Ферменты аминотрансферазы
Взаимодействуют с двумя субстратами
Используют пиридоксальфосфат как кофермент
Пепсин расщепляет в белке связи, образованные
Аминогруппой ароматических аминокислот
Предшественником каких биологически активных веществ является тирозин
Адреналин
Норадреналин
Тироксин
В синтезе аминокислоты цистеин принимают участие
Гомоцистеин
Серин
Какие аминокислоты являются акцепторами аммиака в момент его образования в клетке
Аспартат
Глутамат
Какой вид дезаминирования аминокислот является основным?
Окислительное
Трипсин расщепляет связи в белке, образованные
Карбоксильной группой основных аминокислот
Аминокислота метионин
Необходима для инициации процесса трансляции
В активной форме используется для синтеза адреналина
Поставляет атом S при синтезе цистеина из глюкозы
Какая аминокислота необходима для биосинтеза глутатиона
Цистеин
Какое физиологическое значение имеет образование солей аммония
Регуляция кислотно-основного равновесия
Механизм общего обезвреживания аммиака
Сбережение для организма катионов Na и К
Какие аминокислоты активируют синтез мочевины
Орнитин
Цитруллин
Аргинин
Какая ткань является наиболее чувствительна к действию аммиака
Нервная ткань
Трансаминирование аминокислот
Не приводит к изменению общего количества аминокислот
Что является основным неорганическим компонентом желудочного сока
Соляная кислота
При нарушении окисления фенилаланина в тирозин возникает
Фенилпировиноградная олигрофрения
Какая реакция принимает участие в обезвреживании аммиака с образованием аспаргина и глутамина
Амидирование
Какое соединение образуется из аланина при трансаминировании?
Пируват
Чем определяется пищевая ценность белков
Аминокислотным составом
Возможностью расщепления в жкт
Какие функции может выполнять аланин
Это транспортная форма аммиака в печень для синтеза мочевины
Углеродный скелет аминокислоты используется в реакциях глюконеогенеза
Ферментом, наиболее часто участвующим в образовании аммиака из аминокислот у человека, является
Глутаматдегидрогеназа
Аммиак в высоких концентрациях является токсичным. Какая из перечисленных реакций не включает связывание аммиака
Синтез аргинина из аргининсукцината
В синтезе креатина участвуют
Аргинин
Глицин
Почему необходим процесс аммонийгенеза (синтез солей аммония) в организме
Происходит обезвреживание аммиака
Происходит нейтрализация кислых продуктов
Донорами атомов азота при биосинтезе мочевины в орнитиновом цикле являются
Аммиак
Аспартат
Установить соответствие между названием аминокислоты и ее характеристикой
Фенилаланин-гликогенная и кетогенная аминокислота
Пролин-гликогенная аминокислота
Лейцин-кетогенная аминокислота
Установить соответствие между заболеванием и дефектным ферментом обмена тирозина
Фенилаланилгидроксилаза-фенилкетонурия
Оксидаза гомогентизиновой кислоты- алкаптопурия
Тирозиназа-альбинизм
Установить соответствие между ферментом и его функцией в обмене аммиака
Глутаминсентетаза-нейтрализация аммиака путем синтеза глутамина
Глутаматдегидрогеназа-нейтрализация аммиака путем восстановительного аминирования а-кетоглутарата
Глутаминаза-освобождение аммиака из глутамина в печени и почках
Карбомоилсинтетаза-синтез мочевины
Установить соответствие между продуктом декарбоксилирования аминокислоты и его физиологической функцией
Серотонин-регулирует артериальное давление
ГАМК-тормозной медиатор
гистамин-медиатор воспаления, аллергических реакций
Установить соответствие между аминокислотой и возможным путем ее использования
Глюконеогенез-аланин
Кетогенез-лейцин
Глюкогенез или кетогенез-фенилаланин
Установить соответствие аминокислотой и продуктом ее а-декарбоксилирования
HIS-гистамин
GLU-ГАМК
Орнитин- путресцин
5-окситриптофан- серотонин
Установить соответствие между аминокислотой и ее предшественником
Ala-пируват
Glu- а-кетоглутарат
Asp-оксалоацетат
Ser- 3-фосфоглицерат
Установить соответствие между показателем азотистого баланса и физиологическим состоянием
Положительный азотистый баланс-растущий организм
Азотистое равновесие- полноценная диета, взрослый человек
Отрицательный азотистый баланс-старение
Установить соответствие между исходными веществами и продуктами реакции трансаминирования
Пируват и глутамат- аланин и а-кетоглутарат
Пируват и аспартат- аланин и оксалоацетат (ЩУК)
Оксалоацетат и глутамат- аспарта и а-кетоглутарат
Установить соответствие между аминокислотой и типом ее дезаминирования в организме
Серин- неокислительное дезаминирование
Глутаминовая кислота- прямое окислительное дезаминирование
Валин- трансдезаминирование
Соотнести аминокислоту и продукт ее метаболизма
His- гистамин
Arg- NO
Tyr-адреналин
Cys – глутатион
Соотнести фермент и место его действия на белок
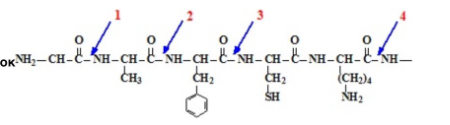
1-аминопептидаза
2-пепсин
3-химотрипсин
4-трипсин
Трипсиноген активируется под действием
Энтеропептидазы
Трипсина
В результате каких процессов в организме образуется аммиак
Дезаминирование пуриновых и пиримидиновых оснований
Дезаминирование аминокислот
Обезвреживание биогенных аминов
Эндопептидаза:
Пепсин
Определите тип реакции, в результате которой при обезвреживании аммиака образуются аспаргин и глутамин?
Амидирование
