
- •Исследование процессов того, что биологического окисает, окислительного фосфорилирования и синтеза атф вариант 2
- •Тема № 7Исследование процессов того, что биологического окисает, окислительного фосфорилирования и синтеза атф вариант 3
- •B. Нарушение синтеза нуклеиновых кислот
- •Исследование процессов того, что биологического окисает, окислительного фосфорилирования и синтеза атф вариант 4
- •Исследование процессов того, что биологического окисает, окислительного фосфорилирования и синтеза атф вариант 5
- •A. Нарушение синтеза нуклеиновых кислот
- •Исследование процессов того, что биологического окисает, окислительного фосфорилирования и синтеза атф вариант 6
- •C. Малату
- •B. Нарушение синтеза нуклеиновых кислот
29. Куда присоединена медь в цитохроме 'а3':
-1. к простетической группе
-2. к порфирину А вместо железа
+3. к апоферменту
30. Кто передает электроны кислороду в цитохромоксидазе:
-1. железо цитохромов 'а'
-2. железо цитохромов 'а3'
+3. медь
-4. порфирин А
31. Чем обусловлен порядок расположения переносчиков электронов в дыхательной цепи:
-1. строением небелковой части
-2. молекулярной массой
-3. строением апофермента
+4. окислительно-восстановительным потенциалом
32. При окислительном фосфорилировании имеет место переход в энергию макроэргических связей АТФ:
-1. механической энергии конформационных изменений
++2. энергии электрохимического потенциала
-3. энергии квантов света
33. Возвращение протонов в матрикс митохондрий из межмембранного пространства происходит путем:
-1. простой диффузии
-2. облегченной диффузии
+3. с помощью АТФ-азы
34. В создании электрохимического потенциала на внутренней мембране митохондрий главную роль играет:
-1. скорость передачи электронов
+2. электрический потенциал
-3. осмотический потенциал
35. Энергия окисления субстратов простой окислительной системой:
-1. используется для образования 1 АТФ
-2. используется для субстратного фосфорилирования
-3. используется для окислительного фосфорилирования
+4. выделяется в виде тепла
36. Где локализованы гидроксилазные окислительные системы:
-1. в наружной мембране митохондрий
-2. в цитозоле
+3. в эндоплазматической сети
37. Микросомальное окисление субстратов осуществляется с целью:
-1. получения энергии
+2. увеличения гидрофильности
+3. обезвреживания ксенобиотиков
+4. синтеза эндогенных веществ
38. Превращение каких эндогенных веществ осуществляется с помощью микросомального окисления:
+1. холестерина в витамин Д
-2. холестерина в его эфиры
+3. холестерина в желчные кислоты
+4. холестерина в стероидные гормоны
+5. фенилаланина в тирозин
39. Какие физические факторы могут вызвать образование свободных радикалов:
+1. ионизирующее излучение
+2. УФ-облучение
+3. свет
+4. радиация
-5. перегревание
40. Какие молекулы в клетках могут реагировать со свободными радикалами:
-1. полисахариды
+2. полиненасыщенные жирные кислоты
-3. насыщенные жирные кислоты
+4. ароматические аминокислоты в белках
+5. нуклеиновые кислоты
41. Укажите природные антиоксиданты:
+1. убихинон
+2. токоферолы
+3. аскорбиновая кислота
+4. витамин К
-5. глюкоза
42. Протонофоры:
-1. переносят протоны и электроны по дыхательной цепи ферментов
+2. переносят протоны через внутреннюю мембрану митохондрий в матрикс
+3. снимают электрохимический потенциал с внутренней мембраны
+4. разобщают окисление и фосфорилирование
43. Ионофоры :
-1. транспортируют ионы к местам депонирования
-2. увеличивают электрохимический потенциал на внутренней мембране
+3. снимают электрический потенциал
-4. снимают осмотический потенциал
44. Прооксиданты:
-1. ускоряют транспорт протонов и электронов по дыхательной цепи ферментов
-2. присоединяют кислород к субстрату
+3. образуют свободные радикалы
45. К какому классу белков относятся цитохромы:
-1. липопротеинам
-2. гликопротеинам
+3. хромопротеинам
46. К какому классу белков относятся флавопротеины:
-1. гликопротеинам
-2. липопротеинам
-3. металлопротеинам
+4. хромопротеинам
47. Выберите названия субстратов, при окислении которых протоны и электроны переносятся на кислород с участием полной дыхательной цепи:
-1. ацил-КоА
+2. пируват
+3. изоцитрат
-4. сукцинат
+5. яблочная кислота
48. Выберите названия субстратов, окисление которых происходит при участии ферментов неполной дыхательной цепи:
+1. ацил-КоА
-2. гидроксиацил-КоА
-3. изоцитрат
+4. сукцинат
-5. малат
49. Выберите названия субстратов, окисляемых простыми окислительными системами:
-1. жирные кислоты
-2. лактат
+3. аминокислоты
+4. пурины
+5. амины
50. В инактивации активных форм кислорода участвуют:
-1. аланинаминотрансфераза
-2. глюкозо-6-фосфатдегидрогеназа
+3. супероксиддисмутаза
+4. глутатионредуктаза
+5. каталаза
1. Сколько связей в АТФ являются макроэргическими: -1. три +2. две -3. одна 2. Какие связи в АТФ являются макроэргическими: -1. сложноэфирные +2. ангидридные -3. гликозидные 3. Где локализованы НАД-зависимые дегидрогеназы: +1. в матриксе митохондрий -2. во внутренней мембране митохондрий -3. в межмембранном пространстве -4. во внешней мембране митохондрий 4. Какой компонент дыхательной цепи свободно перемещается в липидном бислое мембраны: -1. НАД-Н дегидрогеназа -2. цитохромоксидаза +3. убихинон 5. Какой витамин входит в состав коферментов НАД и НАДФ: -1. Р +2. РР -3. В2 -4. В1 6. Что является действующим началом в коферментах НАД и НАДФ: -1. аденин -2. аденозин +3. никотинамид 7. Какой витамин входит в состав ФМН и ФАД: -1. В1 +2. В2 -3. В3 -4. В5 8. Где локализована НАД-Н дегидрогеназа: -1. в матриксе митохондрий +2. во внутренней мембране митохондрий -3. во внешней мембране митохондрий 9. Чем представлена простетическая группа НАД-Н -дегидрогеназы: -1. НАД -2. НАДФ -3. ФАД +4. ФМН 10. НАД является коферментом пиридинзависимых дегидрогеназ: -1. окисляющих субстраты с целью обезвреживания +2. отдающих протоны и электроны в дыхательную цепь ферментов -3. отдающих протоны и электроны непосредственно кислороду 11. НАДФ является коферментом пиридинзависимых дегидрогеназ: -1. окисляющих субстраты с энергетической целью -2. отдающих протоны и электроны в дыхательную цепь ферментов +3. отдающих протоны и электроны в реакциях восстановительного синтеза -4. отдающих протоны и электроны непосредственно кислороду 12. Что является субстратом для окисления у НАД- и НАДФ-зависимой дегидрогеназы: +1. спирты +2. альдегиды -3. жирные кислоты -4. ксенобиотики 13. Что является субстратом для окисления у ФМН-зависимой дегидрогеназы: +1. НАДН+Н -2. жирные кислоты -3. спирты -4. альдегиды 14. Что является субстратом для окисления у ФАД-зависимых дегидрогеназ: -1. НАД.Н+Н -2. спирты -3. альдегиды +4. жирные кислоты 15. Акцептором электронов от флавиновых ферментов в дыхательной цепи является: +1. убихинон -2. цитохром 'в' -3. цитохром 'с' -4. кислород 16. Какую роль играет негеминовое железо: -1. депо железа в организме -2. участвует в синтезе гема +3. является разобщителем потоков протонов и электронов 17. В простых окислительных системах участвуют: -1. пиридинзависимые дегидрогеназы +2. флавиновые ферменты -3. цитохромы -4. убихинон 18. В сложной окислительной системе акцептором протонов и электронов является: -1. субстрат -2. молекула кислорода +3. атом кислорода 19. В неполной дыхательной цепи окисление субстрата осуществляют: -1. НАД-зависимые дегидрогензы +2. ФАД-зависимые дегидрогеназы -3. ФМН-зависимые дегидрогеназы -4. цитохром Р-450 20. В простой окислительной системе акцептором протонов и электронов являются: -1. ксенобиотик -2. атом кислорода +3. молекула кислорода 21. Конечным продуктом сложной окислительной системы является: -1. пероксид +2. вода -3. супероксидный ион 22. В сложной окислительной системе перенос электронов на кислород осуществляют: +1. цитохромоксидаза -2. негеминовое железо -3. убихинон -4. цитохром 'с' 23. Перенос электронов и протонов на кислород в простой окислительной системе осуществляют: -1. цитохромоксидаза -2. негеминовое железо +3. убихинон +4. флавиновый фермент 24. Конечным продуктом простой окислительной системы является: -1. вода +2. перекись водорода -3. супероксидный ион -4. окисленный субстрат 25. Изменение свободной энергии гидролиза макроэргическй связи АТФ в стандартных условиях составляет: -1. 21 кДж/моль -2. 25 кДж/моль +3. 30,2 кДж/моль 26. Что является действующим началом в ФМН и ФАД: -1. рибитол -2. рибофлавин +3. 6,7-диметилизоаллоксазин -4. аденозин 27. Чем отличаются классы цитохромов 'а', 'в' и 'с' друг от друга: +1. строением апофермента +2. строением простетической группы +3. характером связи между простетической группой и апоферментом 28. Чем отличается цитохром 'а3' от цитохрома 'а': -1. строением простетической группы -2. 2. отсутствием атома железа +3. . наличием атома меди 29. Куда присоединена медь в цитохроме 'а3': -1. к простетической группе -2. к порфирину А вместо железа +3. к апоферменту 30. Кто передает электроны кислороду в цитохромоксидазе: -1. железо цитохромов 'а' -2. железо цитохромов 'а3' +3. медь -4. порфирин А 31. Чем обусловлен порядок расположения переносчиков электронов в дыхательной цепи: -1. строением небелковой части -2. молекулярной массой -3. строением апофермента +4. окислительно-восстановительным потенциалом 32. При окислительном фосфорилировании имеет место переход в энергию макроэргических связей АТФ: -1. механической энергии конформационных изменений +2. энергии электрохимического потенциала -3. энергии квантов света 33. Возвращение протонов в матрикс митохондрий из межмембранного пространства происходит путем: -1. простой диффузии -2. облегченной диффузии +3. с помощью АТФ-азы 34. В создании электрохимического потенциала на внутренней мембране митохондрий главную роль играет: -1. скорость передачи электронов +2. электрический потенциал -3. осмотический потенциал 35. Энергия окисления субстратов простой окислительной системой: -1. используется для образования 1 АТФ -2. используется для субстратного фосфорилирования -3. используется для окислительного фосфорилирования +4. выделяется в виде тепла 36. Где локализованы гидроксилазные окислительные системы: -1. в наружной мембране митохондрий -2. в цитозоле +3. в эндоплазматической сети 37. Микросомальное окисление субстратов осуществляется с целью: -1. получения энергии +2. увеличения гидрофильности +3. обезвреживания ксенобиотиков +4. синтеза эндогенных веществ 38. Превращение каких эндогенных веществ осуществляется с помощью микросомального окисления: +1. холестерина в витамин Д -2. холестерина в его эфиры +3. холестерина в желчные кислоты +4. холестерина в стероидные гормоны +5. фенилаланина в тирозин 39. Какие физические факторы могут вызвать образование свободных радикалов: +1. ионизирующее излучение +2. УФ-облучение +3. свет +4. радиация -5. перегревание 40. Какие молекулы в клетках могут реагировать со свободными радикалами: -1. полисахариды +2. полиненасыщенные жирные кислоты -3. насыщенные жирные кислоты +4. ароматические аминокислоты в белках +5. нуклеиновые кислоты 41. Укажите природные антиоксиданты: +1. убихинон +2. токоферолы +3. аскорбиновая кислота +4. витамин К -5. глюкоза 42. Протонофоры: -1. переносят протоны и электроны по дыхательной цепи ферментов +2. переносят протоны через внутреннюю мембрану митохондрий в матрикс +3. снимают электрохимический потенциал с внутренней мембраны +4. разобщают окисление и фосфорилирование 43. Ионофоры : -1. транспортируют ионы к местам депонирования -2. увеличивают электрохимический потенциал на внутренней мембране +3. снимают электрический потенциал -4. снимают осмотический потенциал 44. Прооксиданты: -1. ускоряют транспорт протонов и электронов по дыхательной цепи ферментов -2. присоединяют кислород к субстрату +3. образуют свободные радикалы 45. К какому классу белков относятся цитохромы: -1. липопротеинам -2. гликопротеинам +3. хромопротеинам 46. К какому классу белков относятся флавопротеины: -1. гликопротеинам -2. липопротеинам -3. металлопротеинам +4. хромопротеинам 47. Выберите названия субстратов, при окислении которых протоны и электроны переносятся на кислород с участием полной дыхательной цепи: -1. ацил-КоА +2. пируват +3. изоцитрат -4. сукцинат +5. яблочная кислота 48. Выберите названия субстратов, окисление которых происходит при участии ферментов неполной дыхательной цепи: +1. ацил-КоА -2. гидроксиацил-КоА -3. изоцитрат +4. сукцинат -5. малат 49. Выберите названия субстратов, окисляемых простыми окислительными системами: -1. жирные кислоты -2. лактат +3. аминокислоты +4. пурины +5. амины 50. В инактивации активных форм кислорода участвуют: -1. аланинаминотрансфераза -2. глюкозо-6-фосфатдегидрогеназа +3. супероксиддисмутаза +4. глутатионредуктаза +5. каталаза
Коферментом трансаминаз является :
Пиридоксальфосфат
Из каких соединений образуется активный карамоилфосфат в орнитиновом цикле:
Вода
Углекислый газ
Аммиак
Какие органы участвуют в синтезе креатина
Почки
Печень
Какая рН нормального желудочного сока?
1.5-2.0
Глико-кетогенный является аминокислота
Фенилаланин
Какие функции выполняет Gln?
Является донором амидной группы для биосинтеза
Является транспортной формой аммиака
Условно заменимой аминокислотой является
Цистеин
Какие ферменты отщепляют С-концевые аминокислоты при расщеплении белков
Карбоксипептидазы
Как происходит активация пепсиногена
Соляной кислотой
Аутокаталитически
Какая из перечисленных реакций, происходящих с аминокислотами, дает биогенные амины?
Декарбоксилирование
Какая аминокислота необходима для биосинтеза глутатиона
Цистеин
Что происходит при трансаминировании аминокислот
Межмолекулярный перенос аминогруппы
При превращении аргинина в цитруллин выделяется
Оксид азота
Какой биогенный амин является предшественником норадреналина и адреналина?
Дофамин
В каких процессах участвуют безазотистые остатки аминокислот после дезаминирования?
Синтез заменимых аминокислот
Окисление до СО2 и Н2О
Синтез глюкозы
Частично заменимой аминокислотой является?
Аргинин
Какие ферменты участвуют в прямом дезаминировании аминокислот?
L-оксидазы
Для прямого дезаимнирования аминокислот характерно
Участвуют оксидазы
Коферментом трансаминаз является производное витамина
В6
Оптимальной рН для трипсина является
рН 7-8
Какая аминокислота является акцепторами аммиака в момент его образования в клетке
Глутамат
Незаменимой аминокислотой является
Лейцин (Валин)
Какие вещества необходимы для синтеза гема?
Сукцинил- СоА
Глицин
Как изменяется концентрация мочевины в сыворотке у больных с тяжелыми заболеваниями печени?
Понижается
Аммиак в организме образуется в результате процессов
Дезаминирования аминокислот
Дезаминирования АМФ
Обезвреживание биогенных аминов окислительным путем
N-концевые пептидные связи в белке расщепляет
Аминопептидаза
Общим метаболитом цикла трикарбоновых кислот и орнитинового цикла является
Фумарат
Условно заменимой аминокислотой является
Цистеин
Симптомами гиперамониемии являются тошнота, рвота, головокружение, судороги, потеря сознания. Что вызывает эти симптомы?
Действие аммиака на мозг
Какие конечные продукты образуются при конечном окислении аминокислот
Вода
Аммиак
Углекислый газ
Какой биогенный амин образуется при декарбоксилировании Glu?
Гамма-аминомасляная кислота
Непрямое дезаминирование аминокислот в печени включает последовательно реакции
Переаминирование, дезаминирование Glu
Гликогенной является аминокислота
Аланин
Соляная кислота желудочного сока
Денатурирует белки пищи
Создает оптимум рН для действия пепсина
Вызывает частичный протеолиз пепсиногена
Реакции метилирования в организме осуществляются с помощью аминокислоты
Метионин
Ферменты аминотрансферазы
Взаимодействуют с двумя субстратами
Используют пиридоксальфосфат как кофермент
Пепсин расщепляет в белке связи, образованные
Аминогруппой ароматических аминокислот
Предшественником каких биологически активных веществ является тирозин
Адреналин
Норадреналин
Тироксин
В синтезе аминокислоты цистеин принимают участие
Гомоцистеин
Серин
Какие аминокислоты являются акцепторами аммиака в момент его образования в клетке
Аспартат
Глутамат
Какой вид дезаминирования аминокислот является основным?
Окислительное
Трипсин расщепляет связи в белке, образованные
Карбоксильной группой основных аминокислот
Аминокислота метионин
Необходима для инициации процесса трансляции
В активной форме используется для синтеза адреналина
Поставляет атом S при синтезе цистеина из глюкозы
Какая аминокислота необходима для биосинтеза глутатиона
Цистеин
Какое физиологическое значение имеет образование солей аммония
Регуляция кислотно-основного равновесия
Механизм общего обезвреживания аммиака
Сбережение для организма катионов Na и К
Какие аминокислоты активируют синтез мочевины
Орнитин
Цитруллин
Аргинин
Какая ткань является наиболее чувствительна к действию аммиака
Нервная ткань
Трансаминирование аминокислот
Не приводит к изменению общего количества аминокислот
Что является основным неорганическим компонентом желудочного сока
Соляная кислота
При нарушении окисления фенилаланина в тирозин возникает
Фенилпировиноградная олигрофрения
Какая реакция принимает участие в обезвреживании аммиака с образованием аспаргина и глутамина
Амидирование
Какое соединение образуется из аланина при трансаминировании?
Пируват
Чем определяется пищевая ценность белков
Аминокислотным составом
Возможностью расщепления в жкт
Какие функции может выполнять аланин
Это транспортная форма аммиака в печень для синтеза мочевины
Углеродный скелет аминокислоты используется в реакциях глюконеогенеза
Ферментом, наиболее часто участвующим в образовании аммиака из аминокислот у человека, является
Глутаматдегидрогеназа
Аммиак в высоких концентрациях является токсичным. Какая из перечисленных реакций не включает связывание аммиака
Синтез аргинина из аргининсукцината
В синтезе креатина участвуют
Аргинин
Глицин
Почему необходим процесс аммонийгенеза (синтез солей аммония) в организме
Происходит обезвреживание аммиака
Происходит нейтрализация кислых продуктов
Донорами атомов азота при биосинтезе мочевины в орнитиновом цикле являются
Аммиак
Аспартат
Установить соответствие между названием аминокислоты и ее характеристикой
Фенилаланин-гликогенная и кетогенная аминокислота
Пролин-гликогенная аминокислота
Лейцин-кетогенная аминокислота
Установить соответствие между заболеванием и дефектным ферментом обмена тирозина
Фенилаланилгидроксилаза-фенилкетонурия
Оксидаза гомогентизиновой кислоты- алкаптопурия
Тирозиназа-альбинизм
Установить соответствие между ферментом и его функцией в обмене аммиака
Глутаминсентетаза-нейтрализация аммиака путем синтеза глутамина
Глутаматдегидрогеназа-нейтрализация аммиака путем восстановительного аминирования а-кетоглутарата
Глутаминаза-освобождение аммиака из глутамина в печени и почках
Карбомоилсинтетаза-синтез мочевины
Установить соответствие между продуктом декарбоксилирования аминокислоты и его физиологической функцией
Серотонин-регулирует артериальное давление
ГАМК-тормозной медиатор
гистамин-медиатор воспаления, аллергических реакций
Установить соответствие между аминокислотой и возможным путем ее использования
Глюконеогенез-аланин
Кетогенез-лейцин
Глюкогенез или кетогенез-фенилаланин
Установить соответствие аминокислотой и продуктом ее а-декарбоксилирования
HIS-гистамин
GLU-ГАМК
Орнитин- путресцин
5-окситриптофан- серотонин
Установить соответствие между аминокислотой и ее предшественником
Ala-пируват
Glu- а-кетоглутарат
Asp-оксалоацетат
Ser- 3-фосфоглицерат
Установить соответствие между показателем азотистого баланса и физиологическим состоянием
Положительный азотистый баланс-растущий организм
Азотистое равновесие- полноценная диета, взрослый человек
Отрицательный азотистый баланс-старение
Установить соответствие между исходными веществами и продуктами реакции трансаминирования
Пируват и глутамат- аланин и а-кетоглутарат
Пируват и аспартат- аланин и оксалоацетат (ЩУК)
Оксалоацетат и глутамат- аспарта и а-кетоглутарат
Установить соответствие между аминокислотой и типом ее дезаминирования в организме
Серин- неокислительное дезаминирование
Глутаминовая кислота- прямое окислительное дезаминирование
Валин- трансдезаминирование
Соотнести аминокислоту и продукт ее метаболизма
His- гистамин
Arg- NO
Tyr-адреналин
Cys – глутатион
Соотнести фермент и место его действия на белок
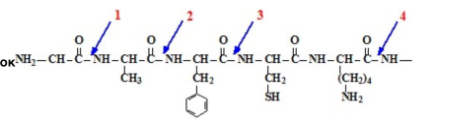
1-аминопептидаза
2-пепсин
3-химотрипсин
4-трипсин
Трипсиноген активируется под действием
Энтеропептидазы
Трипсина
В результате каких процессов в организме образуется аммиак
Дезаминирование пуриновых и пиримидиновых оснований
Дезаминирование аминокислот
Обезвреживание биогенных аминов
Эндопептидаза:
Пепсин
Определите тип реакции, в результате которой при обезвреживании аммиака образуются аспаргин и глутамин?
Амидирование
Для гормоно характерны: роль посредника между Цнс и тканями, дистантность действия
Из триптофана в организме может синтезироваться витамин : РР
Гиповитамино развивается : при неполном усвоении витамина, при недостатке витамина в пище
Для всасывания какого витамина необходим внутренний фактор Кастла? : В12
В клетке-мишени инсулин связывается : с гликопротеиновым рецептором на цитоплазматической мембране
В качестве структурных элементов изопреноидные фрагменты содержат витамины: Е,Д,А
Характеристика гормонов гипоталамуса: не выделяются в кровь, поступают в гипофиз
Одним из наиболее эффективных природных антиоксидантов является: токоферол
Производными нафтохинона являются витамины : филлохинон, менахинон
По месту синтеза различают гормоны: поджелудочная железа, гипоталамус,щитовидная железа
Производными бензохинона является витамин : убихон
Гормоны мозгового вещества надпочечников по химической природе: производные ароматической аминокислоты
Состав FAD входит витамин : В2
Определение соответствующее релизинг – факторам: либерины
Количество атомов углерода в эстрадиоле : 18
В гидроксилировании пролина «созревании» коллагена принимает участие витамин : С
NAD это : никотинамидадениндинуклеотид
Выберите один неправильный ответ : Витамины: являются источниками энергии
Липофильными гормонами являются альдостерон, кортикостерон
Внутриклеточным механизмом взаимодействия с клетками мишенями обладают гормоны: альдостерон, кортикостерон, тироксин
В реакциях дегидрирования участвуют: флавинадениндинуклеотид
Синтез гормонов щитовидной железы непосредственно активирует: тиреотропин
Количество атомов углерода в тестероне: 19
Сколько гидроксильных групп содержит активная форма витамина D3 – 1.25 – дигидроксихолекальциферол? : 3
Витамин, вхлдящий в состав CoA: пантотеновая кислота
Какие гормоны являются производными аминокислот? : тироксин, трийодтиронин
Витаминоподобными веществами нявляются: липоевая кислота
В реакциях переноса одноуглеродных групп участвует в качестве фермента: тетрагидрофолат
Витамин В1 предотвращает развитие : полиневрита
Для гидроксилирования пролина при синтезе коллагена необходима кислота: аскорбиновая
Место синтеза гормона кальцитонина : щитовидная железа
Металлсодержащий витамин: В12
Витамины, образующий коферментные формы : В2, В6
Роль вторичных посредников в действии гормонов выполняют: циклические нуклеотиды, ионы СА2+
Гормон альдостерон синтезируется в: корковом слое надпочечников
Антисеборейным является витамин: биотин
Витамин D3 является предшественником : всех вышеперечисленных веществ
Витамин, не образующий кофермента: F
Атом серы входит в состав витаминов : В1, Н
Гормоны классифицируются по следующим признакам: химической структуре, месту синтеза, действия
Витамин В5 может синтезироваться в оргазме из аминокислоты: триптофана
Действие инсулина заключается в: верного ответа нет
К белково-пептидным гормонам относят: тиреотропин
Витамин, недостаток которого проявляется как болезнь бери-бери: В1
Количество атомов углерода в тестестероне: 19
Витамин, входящий в состав ТПФ (ТДФ) : тиамин
Единица ферменной активности «катал» имеет размерность : моль/сек
Характеристиками жирорастворимых витаминов является: гидрофобные свойствва, могут откладываться жировой ткани
Вазопрессин, в отличие от окситоцина имеет в третьем положении аминокислоту: phe
В формировании активного центра фермента принимают участие: радикалы аминокислот
Международная единица активности ферментов имеет размерность: мкмоль/мин
Общее свойство для ферментов в небелковых катализаторов: катализирует в равной степени в небелковых катализаторов:
Авитаминоз холекальциферола приводит к заболеванию: рахит
Липофильными гормонами является: эстрон, пргестерон
Ферменты, обладающие абсолютной специфичностью, могут осуществлять: превращение только одного субстрата
Для синтеза адреналина необходимы следующие соединения: тирозин, S-аденозилетионин
Где расположен рецепторы для гормонов белково-пептидной природы: на наружней поверхности цитоплазматической мембраны
21 атом углерода содержат гормоны: кортизол, прогестерон, альдостеерон
К катехоламинам относят: адреналин
К белково–пептидным ормонам относят: тиреотропин
Коферрмантная (активная форма.0 витамина В6: пиридоксальфосфат
Какой витамин состоит из двух частей: планарной и нуклеотидной
Участок молекулы фермента, ответственный за присоединение субстрата и за осуществление ферментативного катализа называется: активным центром
Участок молекулы фермента, ответственный за осуществление ферментативного катализа называется: каталитическим центром
Йод входит в состав гормона: кальцитонина
Выберите один неправильный ответ. Основные причины гиповитаминоза: нарушение энергетического обмена организма
Характеристиками витаминов является: низкомолекулярные соединения, регулируют физиологические процессы
Белково-пептидным гормонам является: глюкагон
Окситоцин, вотличие от вазопрессина имеет вместо ARG аминокислоту: Ley
Сколько остатков аминокислот в вазопрессине: 9
Антиоксидантные функции выполняет витамин: С
Что отражает константа Михаэлиса? : сродство к субстрату
Характеристика витамина Е: токоферол, антистерильный
Витамин В12 это : цианкобаламин
Активный центр сложного фермента формируется из: радикалов нескольких аминокислот
Ферменты, в отличие от небелковых катализаторов: обладают высокой специфичностью, катализируют только энергетически возможные реакции
Производными стеролов являются: эргокальциферол, холекальциферол
78. Окситоцин, в отличие от вазопрессина имеет в третьем положении аминокислоту: Ile
79. Укажите определение, характеризующее паракринный регуляторный эффект сигнальных молекул : сигнальные молекулы вырабатывают в пределах одного органа или участка ткани
79. Гормноны гипоталамуса по химической природе: белково-пептидные
80. Какой витамин представлен комплексом полинасыщенных жирных кислот? F
Альбумин имеют при ph 7,0 отрицательный заряд благодаря
- повышенному содержанию в них глутаиновой кислоты
Функция фракции иммуноглобулинов
-защитная
При образовании третичной структуры белка ионная связ возможна His-Lys
Аминокислота к радикалу которой присоединяется фосфорная кислота в фосфолипидах
- Серин
Порядок чередования аминокислот в белках обуславливает - первичная структура
Какой белок будет выходить первым из колонки
430
Конформация пептидной цепи , стабилизируемая между связями аминокислот
- третичная
Простетические группы гликопротеидов содержат – сиаловые кислоты
Из приведенных пептидов выбрать самый гидрофильный Asp-asn –glu
От чего зависит скорость седиментации белков – от молекулярной массы
Из приведенных пептидов выбрать самый гидрофобный - Pro-met-phe-ala
В изоэлектрической точке белок имеет - заряд 0
Какое из свойств характерно для нативных белков - специфическое взаимодействие
Для разделения белков по способу седиментации - ультрацентрифугирование
В электрическом поле пептид asn-glu-val – lys движется к катоду
Для разделения беков по степени распределения между фазами используется метод
Тонкослойной хроматографии
В нейтральной среде заряд пептида val-his-asp-gln меньше 0
Выберите один неправильный ответ: Шаппероны – облегчают разрушение частично …
В электрическом поле пептид arg-asp-ala-trp движется к катоду
Из приведеных пептидов выбрать самый гидрофобный Val-Leu-asn-ile
При образовании третичной структуры водородная связь возможна между аминокислот Ile – phe
В электрическом поле пептид val-his-asp-glu движется к аноду
Какое из отмеченных свойств характерно для денатурированных белков – наличие пептидной связи
Кооперативный эффект при оксигенировании гемолглобина обусловлен взаимным влиянием субъединиц молекул гемоглобина
Пептидная связь в белках является плоской , имеет цис-конформацию альфа спирали
Денатурация белков не вызывает добавление солей щелочных металлов
К глобулярным белкам относятся гистоны
Что обеспечивает первичная структура белка – видовую специфичность
Наименование структуры стабилизируемой водородными связями между пептидными группировками – вторичная
В изоэлектрическом поле пептид arg-asn-glu his остается на месте
Роль шапперонов - защищают новосинтезировнные белки от агрегации, принимают учасие в создании пространственной структуры белка
При образовании третичной структуры липофильное взаимодействие возможно между радикалами аминокислот Leu и Pro
Частое присутствие каких аминокислот в полипептидной цепи снижает вероятность образования а- спирали – trp-pro
Пептидная связь представляет собой амидную связь
Что собой представляет вторичная структура белка? – цепочку ак свернутую в спираль
Положительная проба ксантопротеиновой реакции имеет цвет желтый
Из приведенный пептидов выбрать самый гидрофильный – arg-asp-asn-cys
Ксантопротеиновая реакция является качественной на tyr
Пептид – arg-met-trp может давать качественные реакции : Сакагучи , нитропруссидную, биуретовую
Положительная проба нингидридной реакции имеет цвет сине-фиолетовый
Ксантопротеиновая реакция является качественной реакцией на фенилаланин
Пептид arg-phe-tyr-pro может давать качественные реакции на ксантопротеиновую, Сакагучи, биуретовую
Реакция Адамкевича является качественной на триптофан
Положительная проба Фоля имеет цвет черный
Реакция Сакагучи является качественной на агринин
Ксантопротеиновой реакцией нельзя открыть цистеин, аргинин
Нингидриновая реакция является качественной на свободные а-аминокислоты
Пептид phe-trp-tyr может давать качественные реакции ксантопротеиновую, юиуретовую
Пептид Arg-met-tyr может давать реакцию Сакагучи, нитропруссидну, биуретовую
Пептид cys-phe-trp-tyr может давать качественные реакции ксантопротеиновую, Фоля, биуретовю
Качественной реакцией на присутствие пептидной связи является биуретовая
Реакцией Фоля можно открыть цистеин
Нитропруссидной реакцией можно открыть цистеин, метионин
1. Тканевым дыханием называют:
Перенесение кислорода в тканях
Образование кислорода в тканях
Перенесение электронов к кислороду
Запасание кислорода в тканях
Окисает токсичных веществ
2. Простетичной группой цитохромов является:
A. ФМН
B. Аденин
C. НАД+
D. Витамин РР
E. Гем
3. В дыхательной цепи из одной молекулы ФАДН2 образуется:
5 молекул АТФ
4 молекулы АТФ
3 молекулы АТФ
2 молекулы АТФ
1 молекулу АТФ
4. Что такое окислительное фосфорилирование?
Фосфоролиз гликогена
Перенесение с АТФ остатка ортофосфатной кислоты
Образование АТФ, связано с перенесением электронов
Образование АТФ с АМФ и пирофосфату в дыхательной цепи
Образование АТФ из макроэргических соединений
5. Для которого из отмеченных субстратов тканевого дыхания коефициент фосфорилирования Р/О = 3?
Цитрату
Сукцината
Сукцинил-КоА
Ізоцитрату
Ацил-КоА
6. В который из компонентов дыхательной цепи митохондрий величина редокс-потенциала является максимальной?
A. ФАДН2
B. Цитохрома в
C. НАДН±Н+
D. Цитохрома с1
E. Цитохрома а3
7. Цитохромы – компоненты дыхательной цепи митохондрий, которые переносят электроны от убихинону на молекулярный кислород. Какая часть молекулы цитохрома принимает участие в окиснювально-восстановительных реакциях?
Винильний радикал
Пирольне кольцо
Белковая часть
Атом железа
Метиновий мостик
8. Митохондрии – субклеточные органеллы, что содержатся в цитоплазме всех клеток, за исключением зрелых эритроцитов, бактерий, синьо-зелених водорослей. Какая главная функция митохондрий?
A. Гидролиз веществ
B. Окислительное фосфорилирование
C. Биосинтез белков
D. Секреция
E. Репликация ДНК
9. Какое из приведенных утверждений верное? Последовательность расположения компонентов дыхательной цепи определяется:
A. Химической структурой переносчика
B. Величиной редокс потенциала
C. Величиной протонного электрохимического потенциала
D. Является произвольной
E. Величиной стандартной свободной энергии гидролиза
10. Который из компонентов входит в состав комплекса ІІ дыхательной цепи (Сукцинат-коэнзим Q-редуктази):
A. ФАД
B. Гем
C. тпф
D. НАДФ
E. Цитохром с
11. Автор пероксидной теории того, что биологического окисает:
A. О. Варбург
B. О.Бах
C. В.Энгельгардт
D. В. Палладин;
E. В.А.Белицер.
12. Специфичним акцептором фосфата в процессе окислительного фосфорилирования является:
A. АДФ
B. НАД+
C. АТФ
D. цитохромы
E. ФАД
13. Коферментами флавинзалежних дегидрогеназ являются:
A. ТПФ
B. НАД
C. Гем
D. ФАД
E. ТГФК
14. В реации пероксидной оксидировании привлеченные энзимы:
A. Пиридинзалежни дегидрогеназы
B. Убихинон
C. Монооксигеназы
D. Цитохромы: в, с1, с, а, а3
E. Каталаза
15. Которые из перечисленных компонентов не входят в состав сокращенной дыхательной цепи:
A. НАД-ЗАЛЕЖНИ дегидрогенанзи
B. ФАД-зависимые дегидрогеназы
C. Убихинон
D. Цитохром с
E. Цитохром а + а3
16. Сколько молекул АТФ может синтезироваться при превращении б-кетоглутарата к оксалоацетату:
A. 4
B. 10
C. 9
D. 12
E. 24
17. В состав дыхательной цепи входят все нижеперечисленные вещества, за исключением:
A. НАД, ФМН
B. Зализо-сирчани белки
C. Убихинон
D. Пируват
E. Цитохромы
18. Наиболее энергетическим субстратом дыхательной цепи является:
A. КоQН2
B. НАДН+Н+
C. Сукцинат
D. ФАДН2
E. Аскорбат
19. К какому классу принадлежат ферменты, которые принимают участие в реакциях того, что биологического окисает:
A. Оксидоредуктаз
B. Трансфераз
C. гидролаз
D. Лиаз
E. Ізомераз
20. какой тип ферментов катализирует реакции дегидрирования, в которых как акцептор используется кислород (SR2 + О2 6 S + h2О 2):
A. Анаэробные дегидрогеназы
B. Аэробные дегидрогеназы (оксидазы)
C. Цитохромы
D. Монооксигеназы
E. Диоксигенази
Тема № 7
Исследование процессов того, что биологического окисает, окислительного фосфорилирования и синтеза атф вариант 2
1. Дегидрогеназные реакции биологического окисления и их функциональное значение.
2. Пути включения восстановительных эквивалентов (электронов и протонов) в дыхательную цепь митохондрий.
3. Цитохромы и их роль в тканевом дыхании. Строение их простетической группы.
Тесты
1. Какой порядок размещения цитохромов в дыхательной цепи?
в-с-с1-а-а3
в1 -с1-с-а-а3
в1-с-с1-а-а3
в-с1-с-а-а3
в-с-с1-а3-а
2. В дыхательной цепи из одной молекулы НАДН+Н+ образуется:
5 молекул АТФ
4 молекулы АТФ
3 молекулы АТФ
2 молекулы АТФ
1 молекулу АТФ
3. НАДН+Н+-дегідрогеназа – энзим, что расположен на внутренней мембране митохондрий. В качестве коензима он содержит:
A. НАД+
B. ФАД
C. ФМН
D. НАДН+Н+
E. НАДФ
4. При перенесении электронов в дыхательной цепи митохондрий высвобождается энергия. В каком процессе она используется?
A. Субстратному фосфорилировании
B. Пероксидному окисает
C. Микросомальному окисает
D. Окислительном фосфорилировании
E. Мобилизации жиров
5. Для которого из отмеченных субстратов тканевого дыхания коефициент фосфорилирования Р/О = 2?
A. Малату
B. б-кетоглурату
C. Ізоцитрату
D. Ацил-КоА
E. L-Глутамату
6. В который из компонентов дыхательной цепи митохондрий величина редокс-потенциала является наименьшей?
A. ФАДН2
B. Цитохрома в
C. Цитохрома с1
D. НАДН·Н+
E. Цитохрома а3
7. Какой последний компонент мультиензимного комплекса дыхательной цепи митохондрий, что способен транспортировать как электроны, так и протоны?
Убихинон
НАД
Зализо-сирчаний белок
Цитохром в
Цитохром а3
8. Энзимы дыхательной цепи окиснюють биологические субстраты и транспортируют восстанавливаемые эквиваленты на кислород с образованием молекулы воды. Где они локализуются?
A. На плазматической мембране
B. В цитоплазме
C. На внешней мембране митохондрий
D. В матриксе митохондрий
E. На внутренней мембране митохондрий
9. В некоторых органоидах клетки происходят процессы того, что биологического окисает, спрягают с фосфорилированием, в результате чего высвобождается энергия. В каких органоидах осуществляются эти процессы?
A. Митохондриях
B. Рибосомах
C. Ядре
D. Эндоплазматическому ретикулуми
E. Комплексе Гольджи
10. Который из компонентов входит в состав комплекса И дыхательной цепи (НАДН-коэнзим Q-редуктази):
A. ФАД
B. Гем
C. ФМН
D. Липоевая кислота
E. Сукцинат
11. Важную роль реакций дегидрирования в процессах того, что биологического окисает впервые было отмечено в теории:
A. Д. Кейлиним;
B. О. Варбургом;
C. В. Энгельгардтом;
D. В. Палладиним;
E. В.А.Белицером.
12. Коферментами пиридин-залежних дегидрогеназ являются:
A. ФАД
B. НАД
C. Гем
D. ТПФ
E. ФМН
13. В реакциях того, что биологического окисает принимают участие энзимы:
Пиридинзалежни дегидрогеназы
Монооксигеназы
Каталаза
Цитохром Р450
Цитохром b5
14. активной частью в молекуле НАД+, что акцептует обновительные эквиваленты есть:
A. Аденин
B. Рибоза
C. Остаток фосфорной кислоты
D. Пиридинове кольцо
E. Ізоалаксазинове кольцо
15. активной частью в молекуле ФАД, что акцептует обновительные эквиваленты есть:
A. Аденин
B. Рибоза
C. Остаток фосфорной кислоты
D. Пиридинове кольцо
E. Ізоалаксазинове кольцо
16. Сколько молекул АТФ может синтезироваться при превращении сукцината к оксалоацетату:
A. 4
B. 10
C. 5
D. 12
E. 24
17. В тканевом дыхании принимают участие все вещества, за исключением:
A. Цитохромов
B. Рибофлавина
C. Убихинону
D. Ниацину
E. Пиридоксальфосфата
18. Субстратами тканевого дыхания являются все перечисленные вещества, кроме одной:
A. Ізоцитрат
B. Малат
C. б-кетоглутарат
D. Сукцинат
E. Лактат
19. Назначение дыхательной цепи в митохондриях:
A. Превращение веществ и энергии
B. Окисает веществ к СО2 и Н2О
C. Обеспечение клеток НАД+ и ФАД
D. Перенесение атомов водорода на кислород с образованием АТФ
E. Перенесение электронов на цитохромы
20. какой тип ферментов катализирует реакции дегидрирования, в которых акцептором является химическое соединение (R), отличающееся от кислорода (SR2 + R 6 S + rh2):
A. Анаэробные дегидрогеназы
B. Аэробные дегидрогеназы (оксидазы)
C. Цитохромы
D. Монооксигеназы
E. Диоксигенази
