
protokol_laboranornykh_chast1_TD
.docКафедра “Промышленная теплоэнергетика и теплотехника”
Министерство образования Республики Беларусь
Белорусский национальный технический университет
Кафедра "Промышленная теплоэнергетика и теплотехника"
ЛАБОРАТОРНЫЕ РАБОТЫ
по курсу "Техническая термодинамика"
Исполнитель
Руководитель
Минск, 20
Лабораторная работа №1
ОПРЕДЕЛЕНИЕ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
Цель работы:
закрепление теоретического материала;
определение универсальной газовой постоянной опытным путем.
Объект исследования:
С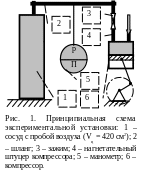 редства
исследования:
редства
исследования:
Установка, используемая при проведении эксперимента, представлена на рис. 1.
Кроме того, при проведении лабораторной работы необходимы: барометр для измерения атмосферного давления, лабораторный термометр для определения температуры окружающего воздуха, лабораторные весы и разновесы к ним.
Методика исследования:
Результаты эксперимента:
Значения, полученные в результате проведения опыта, представлены в таблице 1.
Таблица 1
Протокол наблюдений
№ п/п |
t |
рман |
рабс |
m1ц+вз |
m2ц+вз |
|
oC |
ати |
кПа |
кПа |
кг |
кг |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
… |
|
|
|
|
|
|
… |
|
|
|
|
|
|
Параметры окружающей среды: температура tо. с.= оС, барометрическое давление В= мм. рт. ст. = Па. |
||||||
Обработка результатов измерений:
Объем, занимаемый системой, V, м3
Температура системы, Т, К
Молярная масса воздуха, μ, кг/кмоль
Универсальная газовая постоянная рассчитывается по формуле, R, Дж/(кг·К):
Оценка точности измерений:
Относительная ошибка при определении величины универсальной газовой постоянной может быть найдена из соотношения:
Анализ систематических ошибок:
Оценка случайных ошибок:
Графическое изложение работы:

Выводы:
Вопросы для самопроверки (по выбору преподавателя):
Оцените влияние, которое оказывает на точность определения массы газа в сосуде нарушение условий опыта Т1=Т2
Определите молярные массы различных газов, найдите удельные объемы этих газов при нормальных условиях
Для воздуха, как смеси газов, рассчитайте газовую постоянную, если известны газовые постоянные и концентрации компонентов
Задавшись недостающими величинами и обосновав принятые их значения, рассчитайте оба процесса, протекающих в системе во время опыта
Запишите зависимость универсальной газовой постоянной от молярных теплоемкостей идеального газа
Объясните, почему значение универсальной газовой постоянной (для заданных условий) одинаково для всех газов независимо от их индивидуальных свойств
Что лучше для достоверности результатов с методической точки зрения: воздух в сосуд накачивать (процесс 1–а, рис. 1.2 лабораторной работы №1) или воздух откачивать из сосуда? Как будет выглядеть процессы в pv- , Ts- диаграммах в этом случае?
Определите отношение плотностей двух идеальных газов при одинаковых условиях. Отношение молярных масс газов равно 1,4
Газовая постоянная смеси равна 922 Дж/(кг ·К). Определите кажущуюся молярную массу смеси
Определите количество метана (СН4), которое необходимо закачать в баллон, объем которого равен 1м3, если в начальном состоянии при t1=10C показания вакуумметра 20 кПа. В конечном состоянии, при t1=30C, показание манометра 1 МПа. Давление окружающей среды равно 745 мм. рт. ст. Определите объем этого количества газа, приведенный к нормальным условиям. Какие изменения потребуются в решении этой задачи, если метан заменить гелием (Не)
Определите массовый и объемный составы смеси водорода с азотом, если газовая постоянная ее равна R=922 Дж/(кгК). Определить также парциальные давления компонентов, если абсолютное давление смеси p=0,2 МПа
Дата сдачи:
Оценка работы:
Подпись руководителя:
Лабораторная работа №2
ОПРЕДЕЛЕНИЕ ИЗОБАРНОЙ ТЕПЛОЕМКОСТИ ВОЗДУХА
Цель работы:
закрепление теоретического материала;
ознакомление с методикой определения теплоемкости газообразной среды при использовании проточного калориметра;
экспериментальные проверки величины теплоемкости воздуха, полученной расчетным путем.
Объект исследования:

Средства исследования:
Установка, используемая при проведении эксперимента, представлена на рис. 1, где:
1 проточный калориметр;
2 амперметр;
3 вольтметр;
4 автотрансформатор;
5 электрический нагреватель;
6 автотрансформатор;
7 вольтметр; 8 вентилятор; 9 электропривод вентилятора; 10 лабораторные термометры; 11 пневмометрическая трубка; 12 дифференциальный микроманометр; I-I и II–II контрольные сечения канала калориметра.
Кроме того, при проведении лабораторной работы необходимы: барометр для измерения атмосферного давления, лабораторный термометр для определения температуры окружающего воздуха.
Методика исследования:
Результаты эксперимента:
Значения, полученные в результате проведения опыта, представлены в таблице 1.
Таблица 1
Протокол наблюдений
№ п/п |
t1, oC |
t2, oC |
i, a |
U, B |
Н, мм спирт. ст. |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
… |
|
|
|
|
|
… |
|
|
|
|
|
Параметры окружающей среды: температура tо. с.= оС, барометрическое давление В= мм. рт. ст. = Па. |
|||||
Обработка результатов измерений:
Количество теплоты, выделяющееся в нагревателе, Qэл, кВт·ч
Тепловые потери , QТП, кВт·ч
Динамический напор потока, рД, мм спирт. ст.
Скорость потока среды, w0, м/с
Критерий Рейнольдса (Re)
Средняя по сечению скорость потока, wср, м/с
Расход воздуха при параметрах потока в сечении II – II, V2, м3
Расход воздуха при нормальных условиях (н.у.) , Vн, м3
Объемная изобарная средняя теплоемкость воздуха (согласно формуле 2.7)
Объемная изобарная средняя теплоемкость воздуха (табличное значение)
Объемная изобарная средняя теплоемкость воздуха (воздух смесь газов)
Оценка точности измерений:
Относительная ошибка при определении величины универсальной газовой постоянной может быть найдена из соотношения:
Анализ систематических ошибок:
Оценка случайных ошибок:
Графическое изложение работы:
Выводы:
Вопросы для самопроверки (по выбору преподавателя):
Покажите, может ли теплоемкость иметь отрицательное значение
Покажите, как определяется теплоемкость идеального газа в любом политропическом процессе изменения состояния вещества
Покажите, от чего зависит теплоемкость идеального и реального газов
Как привести объем идеального газа к нормальным условиям
Объясните, что для идеального газа при низких температурах теплоемкость остается практически постоянной
Запишите, какие значения теплоемкости имеют воздух, вода и другие вещества (не менее четырех примеров), с которыми мы имеем дело в повседневной жизни
Получите формулу Майера из одноименного уравнения
В каком интервале температур дана средняя теплоемкость в таблицах и рассчитывается по апроксимирующим формулам
Как рассчитать среднюю теплоемкость в интервале температур t1—t2, если известны теплоемкости в интервалах температур 0—t1 и 0—t2
Какая из теплоемкостей больше: истинная при данной температуре t, или средняя в интервале температур 0—t
Почему удельная объемная теплоемкость отнесена к кубическому метру вещества, определяемому при н. у.
Как связаны удельные массовая, молярная и объемная теплоемкости? Как связаны перечисленные теплоемкости с теплоемкостью системы в целом
Как рассчитать теплоемкость идеального газа в том или ином процессе, если считать ее независящей от температуры
Как интерполировать таблицы теплоемкости для нахождения ее вне узлов таблицы и сохранить точность, характерную данным таблицам
Как найти погрешность данных по теплоемкости, при использовании тех или иных таблиц
Уравнение политропического процесса (р = v). Определите теплоемкость вещества (воздуха, метана, гелия) в данном процессе
Определите мощность потока тепловой энергии и ее количество, которое надо затратить, чтобы сохранить температуру в данном помещении на уровне 18оС, если наружная температура сохранилась равной 8оС, а барометрическое давление выросло в течение 4 часов с 735 до 750 мм рт. ст. Кроме того, в течение часа вытяжная система вентиляции удаляет из помещения 10 м3 воздуха. В помещении находится 20 человек, мощность тепловыделений каждого из которых равна 100 Вт. Рассеянием энергии через стенки пренебречь
Дата сдачи:
Оценка работы:
Подпись руководителя:
Лабораторная работа №3
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ ДЛЯ ВОЗДУХА
Цель работы:
закрепление теоретического материала;
рассмотрение процессов изменения состояния идеального газа;
опытное определение показателя адиабаты или коэффициента Пуассона (k).
Объект исследования:
С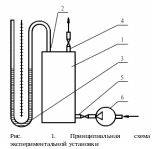 редства
исследования:
редства
исследования:
Установка, используемая при проведении эксперимента, представлена на рис. 1,где:
1 стеклянный баллон;
2 патрубок, соединяющий баллон с U-образным, дифференциальным, водяным манометром;
3 U-образный, дифференциальный, водяной манометр;
4 патрубок, соединяющий баллон с атмосферой;
5 патрубок, соединяющий баллон с насосом;
6 насос.
Кроме того, при проведении лабораторной работы необходимы: барометр для измерения атмосферного давления, лабораторный термометр для определения температуры окружающего воздуха, лабораторные весы и разновесы к ним.
Методика исследования:
Результаты эксперимента:
Значения, полученные в результате проведения опыта, представлены в таблице 1.
Таблица 1
Протокол наблюдений
№ п/п |
|
|
|
|||
мм вод. ст. |
кПа |
мм вод. ст. |
кПа |
мм вод. ст. |
кПа |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
… |
|
|
|
|
|
|
… |
|
|
|
|
|
|
Параметры окружающей среды: температура tо. с.= оС, барометрическое давление В= мм. рт. ст. = Па. |
||||||
Обработка результатов измерений:
Показатель адиабаты (коэффициент Пуассона) k
Термические параметры в характерных точках состояния системы
Изменение удельных внутренних энергий, энтальпии и энтропии
Энергетические характеристики процессов (работа и теплота)
Показатель политропы и теплоемкость газа для каждого процесса
Оценка точности измерений:
Относительная ошибка при определении величины универсальной газовой постоянной может быть найдена из соотношения:
Анализ систематических ошибок:
Оценка случайных ошибок:
Графическое изложение работы:
Выводы:
Вопросы для самопроверки (по выбору преподавателя):
Покажите, что при адиабатном расширении неизбежно происходит уменьшение температуры идеального газа
