
Органическая химия. Ответы к зачету
.pdf
Наибольшую склонность к образованию водородных связей проявляют первичные спирты. Для вторичных и особенно третичных спиртов способность к ассоциации снижается, так как образованию водородных связей препятствуют разветвленные радикалы.
Электронное строение спиртов
Химические свойства спиртов обусловлены их электронным строением. В молекуле спирта кислород, как более электроотрицательный атом, тянет на себя электронную плотность от атомов углерода углеводородного радикала и от водорода. При этом связи С – О и О – Н поляризуются и на атомах углерода и водорода возникают частично положительный (δ+), а на атоме кислорода частично отрицательный (δ-) заряды. Полярность связи О – Н определяет еѐ склонность к гетеролитическому разрыву. Таким образом, атом водорода становится подвижным и способен отщепляться в виде протона (Н+). Следовательно, спирты проявляют свойства ОН-кислот. В то же время у кислорода имеется неподелѐнная донорная электронная пара и спирты проявляют основные свойства. Поэтому можно сказать, что спирты являются амфотерными соединениями. За счет поляризации связи С – О возможен гетеролитический разрыв и для спиртов характерны реакции нуклеофильного замещения
(SN)
Химические свойства 1. Кислотно-оснóвные свойства.
Спирты – слабые амфотерные соединения. Взаимодействие с активными металлами приводит к образованию солей спиртовалкоголятов (кислотные свойства):
Алкоголяты легко гидролизуются, это доказывает, что спирты более слабые кислоты, чем вода и равновесие в реакции со щелочами смещено в сторону исходных веществ.
Кислотность алканолов уменьшается с увеличением длины углеводородного радикала из-за увеличения донорного эффекта радикала. В ряду первичные – вторичные - третичные спирты та же уменьшается.
Взаимодействие с сильными кислотами (основные свойства).
Оснóвным центром в спиртах является атом кислорода, обладающий неподеленной парой оэлектронов. При действии на спирты сильными кислотами происходит присоединение Н+ к атому кислорода группы с образованием донорно-акцепторных связей и образуется неустойчивый алкилоксониевый ион:
2. Реакции с разрывом связи О-Н.
К наиболее характерным реакциям гидроксисоединений, идущим с разрывом связи О–Н, относятся:
•реакции замещения атома водорода на металл (кислотные свойства, смотри выше);
•реакции замещения атома водорода на остаток кислоты (образование сложных эфиров)
1)Реакции взаимодействия спиртов с органическими и минеральными кислотами (реакция этерификации):
21
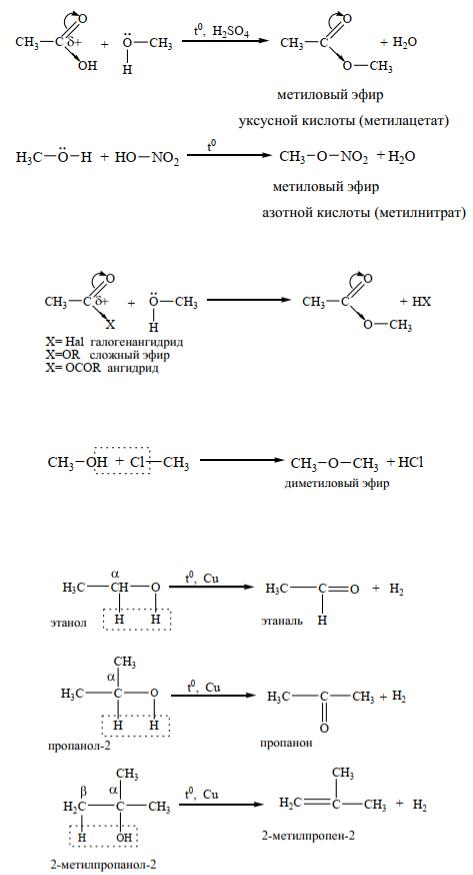
В этих реакциях спирт выступает в роли нуклеофильного реагента. Сложные эфиры так же получают при реакции спиртов с производными карбоновых кислот (реакция ацилирования):
2)Реакции замещения атома водорода на углеводородный радикал (реакция алкилирования, образование простых эфиров) Реакция алкилирования - замещение водорода на углеводородный радикал, протекает под действием галогеналканов.
3)Реакции отщепления водорода при окислении и дегидрировании. Реакции дегидрирования протекают при пропускании паров спирта при 3000 С над медным катализатором. При этом первичные спирты образуют альдегиды, вторичные - кетоны, а третичные спирты в этих условиях подвергаются дегидратации.
Реакции окисления спиртов проводят в различных условиях. Окисление оксидом меди (II) протекает аналогично реакции дегидрирования и приводит в случае первичных спиртов к образованию альдегидов, в случае вторичных - кетонов, третичные спирты в этих условиях не окисляются.
22

3. Реакции с разрывом связи С–О.
Реакция замещения OH-группы на галоген или другую нуклеофильную группу (RO–, NH2– и т.п.) протекает по механизму нуклеофильного замещения SN.
1) Галогенирование:
а) галогенирование происходит под действием хлороводорода
б) заместить гидроксильную группу на галоген легче при действии триили пентахлорида фосфора, тионилхлорида (РСl3, РСl5 и SОСl2)
2) Получение простых эфиров:
В качестве нуклеофильного реагента выступает вторая молекула спирта. В одной молекуле спирта разрывается связь С-О, а в другой О-Н.
Такую реакцию спиртов часто называют межмолекулярной дегидратацией.
3) Реакция дегидратации:
Реакция протекает при избытке Н2SО4 и более высокой температуре, чем в случае реакции образования простых эфиров:
Межмолекулярная дегидратация протекает по правилу Зайцева: «При дегидратации спиртов атом водорода отщепляется от соседнего наименее гидрированного β-углеродного атома»:
23
12. Многоатомные спирты. Химические свойства: кислотные свойства (получение комплексных солей меди (II) – качественная реакция); реакции алкилирования и ацилирования (получение простых эфиров и сложных эфиров с неорганическими икарбоновыми кислотами); реакции замещения спиртовой группы на галоген; реакции окисления.
Многоатомные спирты – это производные углеводородов, в которых несколько атомов водорода замещены на гидроксильные группы (-ОН).
Классификация многоатомных спиртов
У многоатомных спиртов гидроксильные группы обычно находятся у различных углеродных атомов. Соединения с гидроксильными группами у одного атома нестабильны и подвергаются перегруппировкам.
Представителями многоатомных спиртов являются:
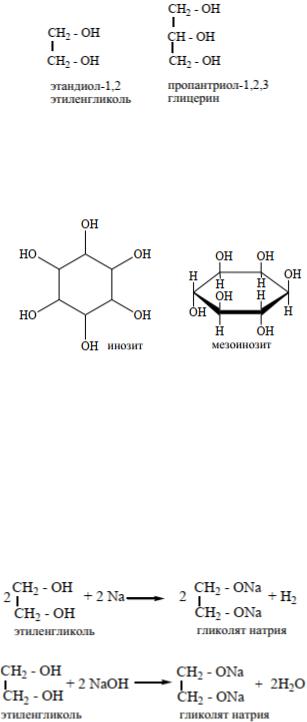
Двухатомные спирты, называются диолами или гликолями, трехатомные триолы или глицерины. Биологически значимыми, наряду с глицеринами, являются пяти- и шестиатомные спирты. Ксилит и сорбит – заменители сахара для больных диабетом. Инозиты шестиатомные спирты циклогексанового ряда. Некоторые стереоизомеры, например мезоинозит (миоинозит) относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных липидов.
Физические свойства многоатомных спиртов
Многоатомные спирты – это вязкие жидкости, сладкого вкуса, хорошо растворимые в воде и этаноле, плохо – в других органических растворителях. Этиленгликоль сильный яд.
Химические свойства многоатомных спиртов
Для многоатомных спиртов характерны реакции одноатомных спиртов и они могут протекать
сучастием одной или нескольких групп –ОН, с образованием моно-, диили поли производных.
1.Кислотно-основные свойства.
Введение в молекулу дополнительных групп ОН, являющихся электроноакцепторами, усиливает кислотные свойства. Таким образом, многоатомные спирты, проявляют более сильные кислотные свойства, чем одноатомные и способны реагировать со щелочами и гидроксидами щелочных металлов (качественная реакция).
а) Взаимодействие с активными металлами:
б) Взаимодействие со щелочами.
в) Взаимодействие с гидроксидами тяжелых металлов (гидроксидом меди) – качественная ре-
акция на многоатомные спирты.
24
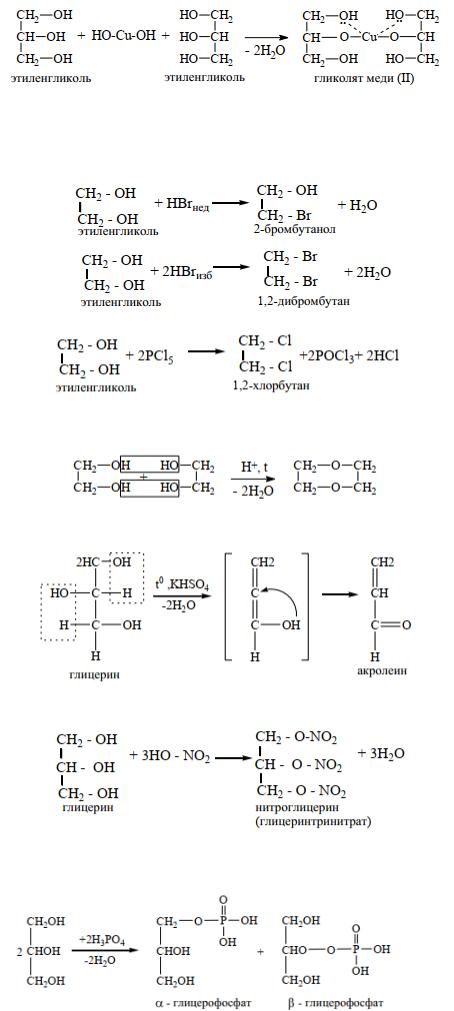
В процессе реакции наблюдается растворение осадка гидроксида меди (II) и образование яркосинего раствора.
2. Галогенирование
а) Взаимодействие с галогеноводородами в недостатке реагента приводит к образованию монопроизводных, а в избытке – продуктов полного замещения гидроксильных групп (дигалогеналканов).
б) Реакция с пятихлористым фосфором идет преимущественно с образование дигалогеналканов
3. Реакция дегидратации
Межмолекулярная дегидратация этиленгликоля приводит к образованию циклического диэфира - диоксана, который используется в качестве растворителя:
Глицерин при нагревании подвергается внутримолекулярной дегидратации с образованием непредельного альдегида (акролеин, слезоточивое вещество):
4. Образование сложных эфиров а) с минеральными кислотами
Нитроглицерин – бесцветная маслянистая жидкость. В виде разбавленных спиртовых растворов (1%) применяется при стенокардии, т.к. оказывает сосудорасширяющее действие.
При взаимодействии глицерина с фосфорной кислотой образуется смесь α- и β-глицерофосфа-
тов:
25
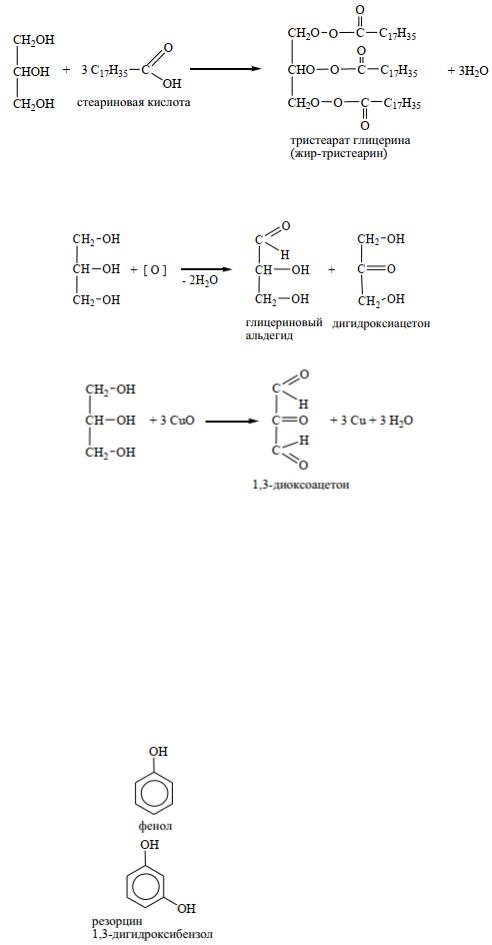
Глицерофосфаты – структурные элементы фосфолипидов, применяются как общеукрепляющее средство.
б) с органическими кислотами.
При взаимодействии глицерина с высшими жирными карбоновыми кислотами образуются жиры:
5. Реакции окисления
При окислении глицерина образуется ряд продуктов.
При мягком окислении – глицериновый альдегид и дигидроксиацетон:
При окислении в жестких условиях образуется 1,3-диоксоацетон:
13. Фенол. Химические свойства: реакции по ОН-группе (кислотные свойства (качественная реакция с хлоридом железа (III)); реакции алкилирования и ацилирования (получение простых эфиров и сложных эфиров с неорганическими и карбоновыми кислотами)); реакции электрофильного замещения по бензольному кольцу: галогенирование (качественная реакция с бромом), сульфирование, нитрование. Реакции восстановления и окисления.
Фенолы – это производные ароматических углеводородов, в которых один или несколько гидроксильных групп непосредственно соединены с бензольным кольцом.
Классификация фенолов (по количеству групп ОН):
•одноатомные
•двухатомные
26

•трехатомные
Номенклатура и изомерия.
Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с группой ОН и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера. Так же широко распространены тривиальные названия.
Для фенолов характерна структурная изомерия, связанная с взаимным расположением замещающих групп в бензольном кольце.
Вряду одноатомных фенолов:
Вряду двухатомных фенолов:
Физические свойства.
Фенол – это бесцветное кристаллическое вещество с резким запахом, плохо растворим в воде при обычной температуре, а при температуре выше 660 смешивается с водой в любых соотношениях. На воздухе окисляется и становится розовым. Фенол – токсичное вещество, вызывает ожоги кожи, его 10% водный раствор называется карболовой кислотой и применяется как антисептик.
Электронное строение фенола.
В молекуле фенола бензольное кольцо и гидроксильная группа (-ОН) взаимно влияют друг на друга. Неподеленная пара электронов атома кислорода гидроксильной группы находится в сопряжении (р, π-типа) с бензольным кольцом. То есть в феноле гидроксильная группа, помимо отрицательного индуктивного эффекта проявляет положительный мезомерный эффект.
Величина положительного мезомерного эффекта больше, чем отрицательного индуктивного, поэтому гидроксильная группа оказывает донорное действие на бензольное кольцо. Вследствие этого электронная плотность в кольце перераспределяется и повышается особенно в орто- и пара-положе- ниях по отношению к гидроксогруппе. В этих положениях возникает частичный отрицательный заряд, что облегчает реакции электрофильного замещения.
27
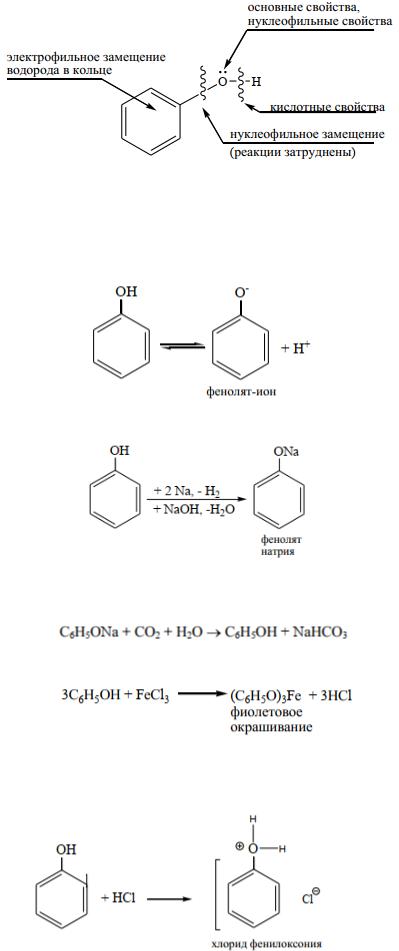
Величина электронной плотности на атоме кислорода за счет донорного эффекта понижается, полярность связи О – Н повышается, что увеличивает подвижность атома водорода и кислотные свойства фенола по сравнению со спиртами.
Условно химические свойства фенола можно представить схемой:
Химические свойства.
Химические свойства фенолов обусловлены наличием группы ОН и бензольного кольца и их взаимным влиянием.
1. Кислотно-основные свойства.
Фенол, как и спирты проявляет слабые амфотерные свойства, с преобладанием кислотных. Фенол диссоциирует в растворе с образованием фенолятиона:
Взаимодействие с активными металлами и щелочами приводит к образованию солей - феноля-
тов (кислотные свойства):
Образующиеся феноляты легко разлагаются при действии кислот. Поэтому при действии угольной кислоты (СО2 + Н2О) и других кислот феноляты легко разлагаются и обратная реакция невозможна.
Фенолы реагируют с солями (хлоридом железа (III)).
Данная реакция является качественной реакцией на фенольный гидроксил:
Каждый фенол дает свое характерное окрашивание в качественной реакции - фенол и резорцин - фиолетовое, пирокатехин и гидрохинон – зеленое, пирогаллол – красное.
Взаимодействие с сильными кислотами (основные свойства).
Фенол в присутствии сильных кислот так же присоединяет протон и образуется неустойчивый фенилоксониевый ион:
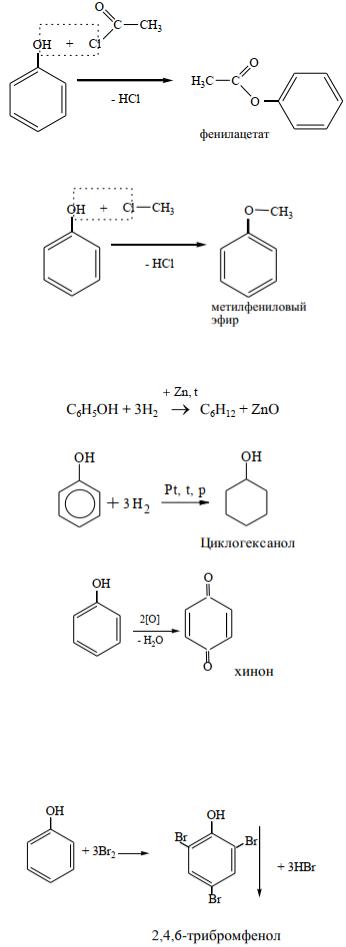
2. Образование сложных эфиров
Сложные эфиры фенола получают реакцией ацилирования (взаимодействием с хлорангидридами кислот).
3. Реакции алкилирования
Простые эфиры получают по реакции алкилирования фенола галогеналканами.
4. Реакции окисления и восстановления а) Реакция восстановления с цинковой пылью при нагревании приводит к образованию цик-
логексана:
Каталитическое гидрирование приводит к восстановлению фенола до циклогексанола.
б) Фенолы легко окисляются под действием кислорода воздуха:
Многие биологические вещества содержат «хиноидную» систему: витамин К2 (фактор свертываемости крови), окислительно-восстановительные ферменты тканевого дыхания – убихиноны.
5. Реакции по бензольному кольцу (электрофильного замещения).
Как было сказано выше, гидроксильная группа облегчает реакции по бензольному кольцу, направляя атаку электрофильного реагента преимущественно в орто- и параположениях:
а) Галогенирование фенола:
29
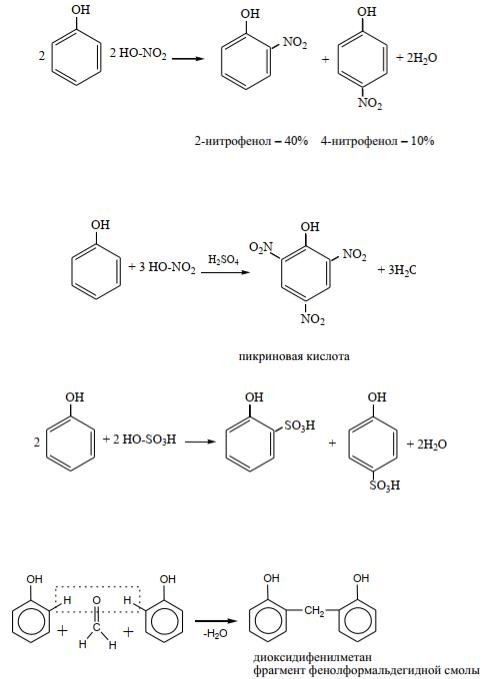
Происходит обесцвечивание бромной воды и образование белого осадка.
Эта реакция используется как качественная реакция на фенол.
б) Нитрование фенола:
Под действием 20% раствора азотной кислоты на холоде фенол превращается в смесь орто- и пара-нитрофенолов:
Для получения 2,4,6-тринитрофенола (пикриновой кислоты) фенол предварительно растворяют в концентрированной серной кислоте, а зате6м подвергают нитрованию концентрированной азотной кислотой:
в) Сульфирование фенола:
5. Реакции поликонденсации.
При взаимодействии с формальдегидом фенол образует полимеры различного строения (линейного, разветвленного, сетчатого) – фенолформальдегидные смолы.
Применение в медицине.
Фенол и его производные обладают дезинфицирующим свойством. Карболовая кислота (3%- ный раствор фенола) применяется для дезинфекции хирургических инструментов. В промышленности фенол используют для получения фенолоформальдегидных смол и ряда красителей.
Резорцин – используется при лечении кожных заболеваний в составе примочек или мазей. Гидрохинон – в организме восстановительная способность замещенного гидрохинонового
фрагмента делает его участником важного процесса транспорта электронов от окисляемого субстрата к кислороду.
Пирокатехин применяется для синтеза адреналина – гормона надпочечников. Адреналин является одним из важнейших регуляторов жизнедеятельности организма. Это первый гормон, который удалось получить синтетически.
30
