
Энерготехнология химических производств
..pdfТем не менее использование абсорбционного метода очистки целесообразно только тогда, когда улавливаемые загрязнения имеют какую-либо ценность: либо для повторного использования, либо как сырье для производства других товарных продуктов. Если улавливаемые материалы не находят никакого практического применения, то неизменно возникнет дополнительная проблема их удаления. Кроме того, низкая концентрация оксидов азота в дымовых газах требует большого времени контакта очищаемого газа с орошающей жидкостью, поэтому нуждается в больших поверхностях массопередачи, т.е. больших размерах оборудования, что приводит к значительным капитальным затратам.
3.2. Методы очистки газовых выбросов от оксида серы
Одним из наиболее крупных и трудно поддающихся очистке загрязнителей атмосферного воздуха, выбрасываемых главным образом энергетическими установками, являются оксиды серы (SO2
ив меньших количествах SO3). В отличие от оксидов азота, оксиды серы образуются только при сжигании топлива, содержащего в своем составе соединения серы. В связи с этим одним из основных путей их снижения является использование топлива с низким содержанием серы (сероочищенного или малосернистого топлива). Тем не менее полностью исключить использование серосодержащих топлив не представляется возможным, поэтому рассмотрим способы очистки газовых выбросов энерготехнологических установок от оксидов серы.
Для удаления SO2 из дымовых газов можно применять «сухие»
и«мокрые» способы. Кроме этого, системы обессеривания отходящих газов подразделяют на две группы:
–дающие продукцию (после очистки газов серосодержащий поглотитель утилизируется);
–дающие отходы (после очистки газов серосодержащий поглотитель не используется).
3.2.1. «Мокрые» способы очистки
Абсорбция. Промывка топочных газов, образующихся при сжигании серосодержащего топлива, достаточно широко используется в промышленности (скрубберная очистка). Однако из-за ограниченной растворимости SO2 в воде обычно применяют щелочную абсорбирующую жидкость, что позволяет нейтрализовать SO2 и увеличить движущую силу процесса абсорбции. Так как дымовые газы со-
101
держат значительное количество CO2, то в сильнощелочных средах СО2 также будет поглощаться, и это приведет к повышенному расходу щелочи за счет образования карбонатов. Для снижения расхода щелочи величину pH абсорбирующей жидкости обычно поддерживают не выше 8,0–8,5.
Насадочные и тарельчатые колонны, обеспечивающие наиболее эффективный контакт газа с жидкостью, являются оптимальными аппаратами для абсорбции при отсутствии твердых частиц (как присутствующих в газовом потоке, так и образующихся в результате реакции).
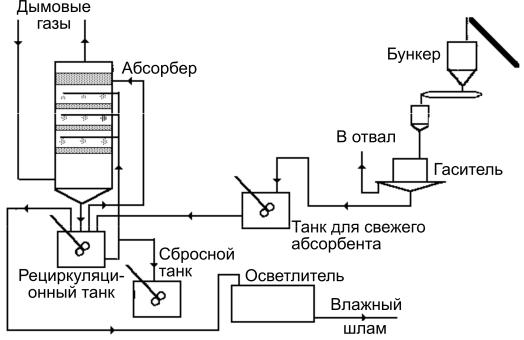
Известковый процесс. В этом процессе циркулирующий раствор извести реагирует с SO2, содержащимся в отходящих газах. Принципиальная технологическая схема метода представлена на рис. 3.5.
Рис. 3.5. Технологическая схема известкового процесса
При взаимодействии образуются сульфит и сульфат кальция, которые отделяются в отстойниках и фильтрах. Образующийся шлам может быть химически стабилизирован с целью превращения в инертный материал, пригодный для смешивания с почвой, или слит в шламовые пруды, оборудованные гидроизоляцией, предотвращающей загрязнение почвы и почвенных вод.
В основе метода лежат следующие реакции:
CaO + H2O = Ca(OH)2 = Ca2+ + 2OH–,
SO2 (г) = > SO2 (р) + H2O = 2H+ + SO32–.
102
Сульфит-ион в конечном счете превращается в гипс:
SO32– + 0,5O2 = SO42– + Ca2+ + 2H2O = CaSO4 × 2H2O (тв).
Избыток в потребности извести составляет примерно 5 % по массе от количества улавливаемого SO2.
Эксплуатация известковых систем на ряде энергетических котельных показала возможность удаления более 90 % исходного количества SO2.
Известняковый процесс. Очистка дымовых газов с помощью известняка имеет много общего с известковым способом. Однако в известняковом процессе используется известняковый шлам, следовательно, для подготовки суспензии требуется другое оборудование. Кроме того, из-за меньшей реакционной активности известняка по сравнению с известью известняковый процесс требует большей величины отношения «жидкость – газ». Точное значение отношения «жидкость – газ» зависит от требуемой степени улавливания SO2, его концентрации в поступающем потоке, начального значения pH абсорбента и других параметров. Однако, несмотря на эти различия, можно разработать единую систему для работы как на извести, так и на известняке.
В известняковом процессе протекают следующие реакции:
CaCO3 (тв.) = CaCO3 (р-р) = Ca2+ + CO32–,
SO2 (газ.) = > SO2 (р-р) + H2O = 2H+ + SO32–,
SO32– + 0,5O2 = SO42– + Ca2+ + 2H2O = CaSO4 × 2H2O (тв.).
Эффективность системы зависит от количества подаваемого известняка, однако увеличение его количества выше определенного предела, соответстующего максимальной эффективности, может быть нерационально. Известняковые системы могут обеспечить улавливание SO2 на 90 % и выше.
Двухщелочной процесс. Известковый и известняковый способы являются относительно дешевыми способами очистки, однако многие соли кальция имеют ограниченную растворимость, поэтому при использовании кальциевых растворов возможна забивка трубопроводов, форсунок, насадки и т.п. Альтернативным решением проблемы забивки оборудования является использование в абсорберах хорошо растворимых щелочных агентов.
Например, при использовании двухщелочной очистки диоксид серы поглощается натриевым раствором в абсорбере, а затем рас-
103
твор регенерируется в отдельной системе, взаимодействуя с кальциевым щелочным шламом. Регенерированный абсорбент вновь подается в абсорбционный контур, а смесь сульфита и сульфата кальция осаждается и удаляется. Щелочной раствор, используемый для абсорбции SO2, может содержать соединения калия, натрия или аммиака (обычно в качестве абсорбента используют натриевые соли).
Процесс протекает по следующим уравнениям реакций:
2NaOH + SO2 = Na2SO3 + H2O,
Na2CO3 + SO2 = Na2SO3 + CO2,
Na2SO3 + SO2 + H2O = 2NaHSO3,
NaOH + SO2 = NaHSO3.
В свою очередь, сульфит натрия может окисляться кислородом воздуха в сульфат:
Na2SO3 + 0,5O2 = Na2SO4.
После абсорбции SO2 жидкость подается в систему регенерации и реагирует с известью:
Na2SO3 + Ca(OH)2 + 0,5H2O = NaOH + CaSO3 × 0,5H2O,
Na2SO4 + Ca(OH)2 + 2H2O = 2NaOH + CaSO4 × 2H2O.
Осажденные сульфит и сульфат кальция отделяют от регенерированной жидкости. Иногда в системе регенерации используется известняк.
Для достижения максимального удаления SO2 при оптимальном расходе энергии в промышленности используют скрубберы различного типа, из которых наиболее распространены тарелочные и насадочные колонны.
Следует учитывать, что процесс абсорбции SO2 гидроксидом или карбонатом натрия (сода) может оказаться экономически выгодным в тех случаях, когда образующиеся бисульфит или сульфит натрия находят применение на бумагоделательных фабриках.
Процесс Веллмана−Лорда. Этот процесс является типичным хемосорбционным процессом с регенерацией абсорбента. В качестве абсорбента используется водный раствор сульфита натрия. Абсорбция осуществляется преимущественно в башенных тарелочных абсорберах. Технологическая схема метода представлена на рис. 3.6.
104
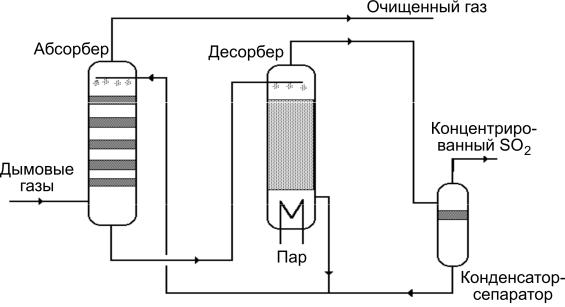
Рис. 3.6. Технологическая схема процесса Веллмана–Лорда
Перед подачей на очистку дымовой газ обязательно пропускают через скруббер Вентурри или предскруббер тарелочного типа, где он охлаждается примерно до 50 °С, увлажняется и очищается от летучей золы и хлоридов. При поглощени SO2 жидким абсорбентом образуется бисульфит натрия:
Na2SO3 + SO2 + H2O = 2NaHSO3.
Также возможно протекание побочной реакции его окисления кислородом воздуха в сульфат:
Na2SO3 + 0,5O2 = Na2SO4.
При регенерации бисульфит натрия разлагается в десорбере:
2NaHSO3 = Na2SO3 + SO2 + H2O.
Регенерированный абсорбент охлаждается и подается в абсорбер, а концентрированный SO2 в дальнейшем может быть сжижен или переработан в SO3, серную кислоту или элементарную серу. Образующийся в качестве побочного продукта сульфат натрия должен удаляться из системы и утилизироваться.
Эффективность очистки дымовых газов в процессе Веллмана−Лорда составляет 90 % и более.
105
3.2.2. «Сухие» способы очистки
Угольное топливо с добавками известняка. Для уменьше-
ния содержания SO2 в дымовых газах энерготехнологических установок, работающих на угольном топливе, были разработаны два способа введения известняка в топливо:
–приготовление гранул из угольной крошки с добавкой известняка для сжигания в колосниковых топках;
–добавление порошкообразного известняка к угольной пыли для использования в топках с форсуночным распылением топлива.
Реакция связывания SO2 в процессе горения описывается уравнением
CaCO3 +0,5O2 + SO2 = CaSO4 + CO2.
Использование гранул с добавкой извести снижает концентрацию оксидов серы на 50 % при сжигании в колосниковых топках небольшой мощности. Эти показатели несколько ниже, чем для традиционной очистки газов от SO2 методом промывки, однако если учесть простоту метода, то он имеет значительные перспективы.
При сжигании угольной пыли с добавками извести в топках форсуночного типа достигается снижение оксидов серы до 70 %.
Введение сухого адсорбента. В данном способе сухой ще-
лочной адсорбент вдувается в магистраль дымовых газов, а прореагировавшие твердые продукты затем отделяются от потока. Таким образом, концентрацию SO2 в дымовом газе можно снизить на 50 %. Экспериментально установлено, что натриевые соли гораздо эффективнее кальциевых соединений. Их реакция с оксидами серы описывается уравнениями:
2NaHCO3 + SO2 = Na2SO3 + 2CO2 + H2O,
Na2CO3 + SO2 = Na2SO3 + CO2.
В качестве адсорбента удобно использовать нахколит – природный минерал Na2CO3 · NaHCO3 · 2H2O, который недорог и отличается хорошей реакционной способностью. Реакция протекает с достаточной скоростью при температуре 110–150 °C, а повышение температуры приводит к увеличению степени использования адсорбента.
Фирмой Tampella разработан метод Lifak, основанный на дозированной подаче известняка в топку котла для сжигания угля и мазута, а также дополнительной активации извести в отдельном реак-
106
торе. Наиболее применимым в данном случае считается реактор кипящего слоя. Связывание SO2 происходит следующим образом:
CaCO3 = CaO + CO2,
CaO + SO2 = CaSO3,
CaSO3 + 0,5O2 = CaSO4.
Рабочий диапазон температур составляет 800–1200 °С. Непрореагировавший CaO активируются водой и реагирует далее:
Ca(OH)2 + SO2 = CaSO3 + H2O.
Основные преимущества процесса Lifak:
–дешевый адсорбент;
–возможность применения на существующих и новых электростанциях, на всех типах котлов, работающих на серосодержащих топливах;
–малая площадь оборудования и простота монтажа;
–отсутствие сточных вод;
–конечный продукт используется в качестве насыпного грунта или дорожно-строительного материала.
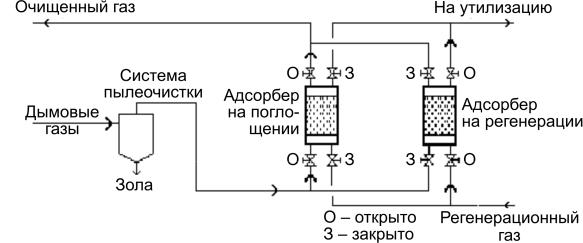
Адсорбция твердым адсорбентом CuO/CuSO4. Этот метод обеспечивает очистку газов от SO2 в присутствии оксида меди CuO, нанесенного на оксид алюминия. Топочный газ подается в реактор
спараллельным расположением каналов для прохождения газового потока, заполненных адсорбентом. Принципиальная технологическая схема представлена на рис. 3.7.
Рис. 3.7. Принципиальная технологическая схема адсорбции оксидом меди
107
Химизм процесса может быть представлен уравнениями:
– адсорбции:
CuO + 0,5O2 + SO2 = CuSO4;
– регенерации:
CuSO4 + 2H2 = Cu + SO2 + 2H2O,
Cu + 0,5O2 = CuO.
Дымовой газ при 390 °С подается в один из реакторов, где оксид серы взаимодействует с CuO с образованием сульфата меди. После насыщения топочный газ переключается на новый реактор, а отработанный подвергается регенерации. При этом выходящий из реактора поток содержит достаточное количество SO2 для получения серной или сернистой кислоты.
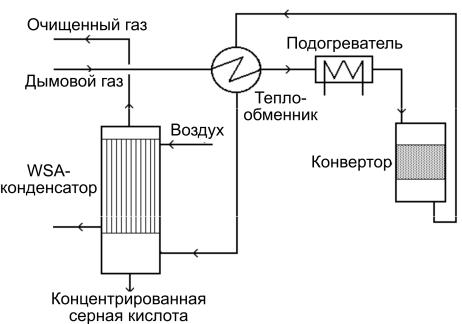
Технология WSA. WSA – это каталитический процесс, приводящий к получению серной кислоты из «мокрого» газа. Его принципиальная технологическая схема изображена на рис. 3.8.
Химизм процесса может быть представлен следующими реакциями:
2SO2 + O2 = 2SO3,
SO3 + H2O = H2SO4.
Рис. 3.8. Технологическая схема процесса WSA
108
Окисление SO2 в SO3 происходит при температуре около 420 °С на ванадиевом катализаторе. Теплота химической реакции используется для подогрева газа, входящего в реактор. Далее технологический газ охлаждается, а SO3 с парами воды превращается в аэрозоль серной кислоты. Если дымовой газ содержит малое количество воды, то в него добавляют пар. Серная кислота выделяется в башне WSA, которая представляет собой трубчатый конденсатор/концентратор с трубками, стойкими в среде серной кислоты (например, изготовленными из стекла). Концентрация серной кислоты мало зависит от содержания в дымовом газе воды, так как температура точки росы серной кислоты значительно выше, чем температура точки росы воды.
Степень очистки дымовых газов может достигать 95–98 %.
Адсорбция твердыми поглотителями. Адсорбенты явля-
ются эффективным средством для рекуперации и обезвреживания оксидов серы. Обычно в качестве адсорбентов используются активные угли, цеолиты, силикагели. Однако данные способы требуют низких температур.
Известен способ адсорбции SO2 на активированном угле, поверхность которого также поглощает из дымовых газов кислород и воду с одновременным окислением SO2 в SO3. Химизм процесса может быть представлен следующими реакциями:
2SO2 + O2 = 2SO3,
SO3 + H2O = H2SO4.
Принципиальная схема системы очистки похожа на схему, представленную на рис. 3.7, и отличается только технологической обвязкой адсорбера (рис. 3.9).
Дымовые газы из котла проходят через пылеуловитель и несколько параллельно включенных адсорберов, заполненных активным углем. Причем часть адсорберов находится на стадии адсорбции, а часть – на стадии регенерации. Так как в процессе адсорбции в порах активированного угля образуется серная кислота, то на стадии регенерации происходит ее отмывка. Сначала промывку ведут достаточно концентрированной серной кислотой, затем последовательно – кислотой средней, потом низкой концентрации и, наконец, водой. Далее раствор проходит через маслоотделитель и собирается в емкости. Жидкость, полученная при промывке, является
109
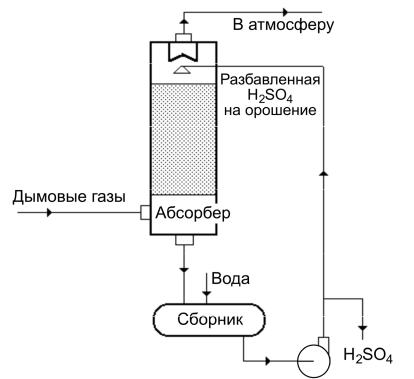
Рис. 3.9. Технологическая обвязка адсорбера
20%-й серной кислотой. Ее упаривают до концентрации 70 %, а затем после охлаждения и центрифугирования отправляют потребителю как товарный продукт. После промывки уголь сушат очищенными дымовыми газами и адсорбер переключают на поглощение.
3.3. Комплексная система очистки дымовых газов
Представленные выше системы очистки позволяют очищать дымовые газы только от оксидов азота или оксидов серы. В связи с этим для полной очистки дымовых газов необходимо использовать комплексные системы очистки от оксидов азота и серы совместно, которые можно комбинировать из представленных выше методов. Пример такой технологической схемы представлен на рис. 3.10.
Так, для очистки дымовых газов от SO2 комплексная схема может использовать метод адсорбции SO2 на активированном угле с последующим окислением до SO3 и гидрированием до серной кислоты.
После очистки от диоксида серы дымовые газы подаются на очистку от оксидов азота методом НСКВ, который позволяет дополнительно реализовать процесс сжигания (для всей системы) с коэффициентом избытка воздуха, равным единице.
110
