
Органические соединения. Часть 2. Кислородсодержащие и высокомолекуля
.pdf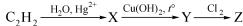
ТЕСТЫ ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ
Тест № 1
1. Общая формула гомологического ряда насыщенных альде-
гидов |
|
|
|
|
|
1) CnH2n(OH)2 |
4) CnH2n+1OH |
|
|
||
2) CnH2n–2O |
5) CnH2n+1O |
|
|
||
3) CnH2nO |
|
|
|
|
|
2. Реагент для отделения этанола от этаналя |
|
||||
1) H2SO4 |
2) CH3COOH |
3) KOH |
4) Ag2O в NH3 |
5) толуол |
|
3. Вещество Х в уравнениях реакций C2H2 → X → CH3COOH |
|||||
1) C2H6 |
2) C2H5OH |
3) CH3CHO |
4) C2H2Br4 |
5) C2H4Br2 |
|
4. Название соединения Z в следующем превращении:
1) |
этаналь |
4) |
хлоруксусная кислота |
2) |
хлорэтан |
5) |
1,2-дихлорэтан |
3) |
этиленгликоль |
|
|
5. С аммиачным раствором оксида серебра реагирует |
|||
1) |
бутин-2 2) этилен |
3) бутин-1 4) этанол 5) циклогексен |
|
6.Фенол реагирует с каждым из указанных веществ
1)бромная вода и гидроксид натрия
2)гидроксид натрия и вода
3)вода и соляная кислота
4)соляная кислота и бромная вода
5)вода и бромная вода
7.Сложные эфиры может образовывать
1)ацетальдегид
41
2)акриловая кислота
3)толуол
4)бромная вода
5)бензол
8. Объем 25%-ного раствора гидроксида калия (ρ = 1,23 г/мл), который нужно затратить для проведения гидролиза 30 г смеси, состоящей из этилового эфира уксусной кислоты, изопропилового эфира муравьиной кислоты и метилового эфира пропионовой ки-
слоты, составляет (мл) |
|
|
||
1) 62 |
2) 67 |
3) 72 |
4) 77 |
5) 75 |
9. На нейтрализацию смеси муравьиной и уксусной кислот израсходовано 10 мл раствора с массовой долей гидроксида калия 0,40 (ρ = 1,40 г/мл). При взаимодействии такого же количества смеси
с избытком |
аммиачного |
раствора оксида |
серебра образовалось |
|
8,64 г серебра. Массовая доля уксусной кислоты в смеси равна |
||||
1) 0,66 |
2) 0,63 |
3) 0,54 |
4) 0,48 |
5) 0,34 |
10. При добавлении избытка металлического натрия к смеси этанола с фенолом выделилось 896 мл (нормальные условия) водорода. При действии избытка раствора брома на такое же количество смеси этанола с фенолом образовался осадок массой 9,93 г.
Массовая доля этанола в смеси равна |
|
|||
1) 0,50 |
2) 0,45 |
3) 0,40 |
4) 0,35 |
5) 0,30 |
Тест № 2
1. К классу сложных эфиров относится вещество состава
1) С2H6O 2) C2H4O2 3) C2H6O2 4) C2H4O 5) C2H2O
2. Для выделения альдегидов из их смеси с бензолом и этанолом можно использовать
42

1) HCl |
4) |
толуол |
2) H2SO4 |
5) |
уксусную кислоту |
3) NaHSO3 |
|
|
3. Название соединения Z в следующих превращениях:
1) |
пропионат натрия |
4) |
пропанол-2 |
2) |
пропаналь |
5) |
глицерин |
3) |
пропанол-1 |
|
|
4. Название соединения Z в следующих превращениях:
1) |
этаналь |
4) |
диэтиловый эфир |
2) |
ацетат натрия |
5) |
этанол |
3)этилацетат
5.Если пропанол-1 подвергнуть дегидратации, а затем на полученное соединение подействовать хлороводородом, получится
1) |
1,2-дихлорпропан |
4) |
хлорэтан |
2) |
2-хлорпропан |
5) |
1,1-дихлорпропан |
3) |
1-хлорпропан |
|
|
6. Пропаналь можно получить
1)гидрированием пропановой кислоты
2)окислением пропанола-1
3)гидратацией пропина
4)гидролизом метилпропионата
5)окислением пропанола-2
7. Продуктом восстановления пропаналя является
1) пропанол
43
2)пропановая кислота
3)пропанон
4)пропан
5)пропин
8. Алкен присоединил количественно 24,3 г бромоводорода. При нагревании полученного продукта с водным раствором гидроксида калия с выходом продукта реакции получено 10,8 г спирта. Формула исходного алкена
1) C2H4 2) C3H6 3) C4H8 4) C5H10 5) C6H12
9.Уксусная кислота содержит примеси уксусного альдегида
иэтанола. При обработке образца кислоты массой 10 г избытком аммиачного раствора оксида серебра образовался металлический осадок массой 6,48 г. На нейтрализацию такого же образца кислоты потребовалось 42,42 мл раствора с массовой долей гидроксида ка-
лия 0,12 (ρ = 1,10 г/мл). Массовая доля этанола в техническом об-
разце кислоты |
|
|
|
|
1) 0,21 |
2) 0,08 |
3) 0,40 |
4) 0,27 |
5) 0,13 |
10. Объем раствора с массовой долей фенола в бензоле 0,094 (ρ = 0,9 г/мл), который должен прореагировать с избытком металлического натрия для получения такого количества водорода, чтобы его хватило на полное каталитическое гидрирование 2,24 л (нормальные условия) ацетилена, составляет (мл)
1) 111 |
2) 222 |
3) 333 |
4) 444 |
5) 555 |
|
|
|
Тест № 3 |
|
1. Из крахмала массой 8,1 г получили глюкозу, выход которой составил 70 %. К глюкозе добавили избыток аммиачного раствора оксида серебра. Масса образовавшегося при этом серебра состав-
ляет (г) |
|
|
|
|
1) 10,8 |
2) 5,4 |
3) 16,2 |
4) 21,6 |
5) 54 |
44 |
|
|
|
|
2. Выход тринитроцеллюлозы составляет 66,7 %. Раствор азотной кислоты имеет массовую долю 80 % и плотность 1,46 г/мл. Для получения тринитроцеллюлозы массой 990 кг надо взять целлюлозу массой (кг) и раствор азотной кислоты объемом (л)
1) |
8,1 и 6,472 |
4) |
81 и 647,2 |
2) |
810 и 647,2 |
5) |
810 и 64,72 |
3) |
81 и 64,72 |
|
|
3. Вещества, которые способствуют протеканию реакции полимеризации, называются
1) |
индикаторы |
4) инициаторы |
2) |
ингибиторы |
5) адсорбенты |
3) |
пластификаторы |
|
4. Для получения полистирола необходимо использовать мо- |
||
номер |
|
|
1) C6H5C2H5 |
4) C6H5CH=CH2 |
|
2) C6H6 |
5) C6H5ОH |
|
3) C6H5CH3 |
|
|
5. Дивиниловый каучук получают из следующего исходного |
||
сырья: |
метана 2) бутана 3) этана 4) пропана 5) пентана |
|
1) |
||
6.Реакция полимеризации пропилена приводит к образованию полимера следующего строения:
1) [–СH(CH3)–CH2–CH2–]n 2) [–СH2–CH(CH3)–]n
3) [–СH2–CH2–CH2–]n 4) [–СH2–CH(Cl)–]n 5) [–СH2–CH2–]n
7.Бутадиеновый каучук образуется в результате реакции
1) дегидрирования бутана
45
2)полимеризации бутена-2
3)дегидратации и дегидрирования этанола
4)полимеризации дивинила
5)окисления бутена-2
8.Природные полимеры крахмал и целлюлоза построены из остатков
1) фруктозы 2) мальтозы 3) глюкозы 4) сахарозы 5) галактозы
9.Полимер, которому соответствует формула
[–СH(ОCОCH3)–СН2–]n, называется 1) полиметилметакрилат 2) полистирол 3) полиуретан
4) поливинилацетат
5) полибутилен
10.Для получения синтетического каучука по методу С.В. Лебедева в качестве исходного сырья использовали
1) CH4 2) CH3COOH 3) C2H5OH 4) C3H6O 5) C6H6
ЛАБОРАТОРНЫЕ РАБОТЫ
Углеводороды
Цель работы: познакомиться с лабораторными способами получения некоторых представителей гомологического ряда предельных, этиленовых, ацетиленовых и ароматических углеводородов и изучить их свойства.
1. Получение алканов и изучение их свойств
а) Получение и горение метана
Тщательно разотрите в ступке обезвоженный ацетат натрия и перемешайте его с удвоенным количеством натронной извести
46
(смесь NaOH и CaO). Однородную порошкообразную смесь веществ поместите в сухую пробирку, заполнив ее примерно на 1/3, закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки. В процессе нагревания пробирку держите почти горизонтально, с небольшим наклоном в сторону горлышка пробирки, чтобы выделяющаяся вода собиралась у горлышка пробирки и не стекала на нагретую часть пробирки. Постепенно перемещайте пробирку в пламени от дна к ее горлу, чтобы могли реагировать новые порции смеси.
Выделяющийся газ пропустите последовательно в две заранее приготовленные пробирки, в одной из которых находится раствор перманганата калия, а в другой – бромная вода. Изменяется ли окраска этих реактивов? Объясните наблюдаемые явления.
Не прекращая нагревание, поверните газоотводную трубку вверх и подожгите метан у ее выхода. Обратите внимание на цвет пламени. Что наблюдаете? Напишите уравнение получения метана и его горения. Сделайте вывод о химических свойствах предельных углеводородов.
б) Реакции обнаружения галогеналканов
Хлор, бром, иод в галогеналканах могут быть обнаружены пробой Бельштейна. Она состоит в том, что галогенопроизводные при нагревании с медью дают летучие галогениды меди, окрашивающие пламя в зеленый цвет.
Медную проволоку диаметром 1–2 мм c петлей на конце прокалите в бесцветной части спиртовки до прекращения окрашивания пламени. По охлаждении проволоки петлю опустите в раствор хлороформа и внесите в пламя спиртовки. В присутствии галогенов появляется окраска пламени вследствие образования летучих галогенидов меди. Отметьте цвет пламени. Составьте уравнение реакции. Повторите опыт, опуская проволоку в заведомо не содержащую галоген жидкость (дистиллированная вода, спирт).
Объясните, почему происходит почернение медной проволоки при ее прокаливании в пламени спиртовки? Из каких галогенопроизводных можно получить 2,4-диметилпентан по реакции Вюрца?
47
2.Получение этилена и изучение его свойств
Впробирку налейте 4–5 мл смеси этилового спирта с концентрированной серной кислотой (1:1). Для равномерного кипения жидкости добавьте в пробирку немного сухого песка. Закройте пробирку пробкой с газоотводной трубкой и осторожно нагрейте смесь в пламени спиртовки до ровного кипения. Если жидкость начинает бурно кипеть и пениться, временно прекратите нагревание. Не касайтесь нагретой пробиркой фитиля спиртовки. Составьте уравнение реакции получения этилена.
Для изучения свойств этилена в одну пробирку налейте 2–3 мл бромной воды, в другую – столько же раствора перманганата калия (0,01%-ный раствор, подкисленный серной кислотой). Через каждую пробирку последовательно пропустите этилен. Объясните наблюдаемые изменения. Составьте уравнения реакций и расставьте коэффициенты, используя метод электронного баланса. Сделайте вывод о том, какие типы реакций наиболее характерны для этиленовых углеводородов.
3.Получение ацетилена и изучение его свойств
Ацетилен можно получать в приборе для получения этилена. В пробирку налейте 3–5 мл воды и добавьте несколько кусочков карбида кальция. Выделяющийся газ ацетилен пропустите последовательно в три предварительно подготовленные пробирки:
1)с 0,1%-ным раствором перманганата калия, подкисленного серной кислотой (1–2 мл);
2)с бромной водой (1–2 мл);
3)с аммиачным раствором оксида серебра (2–3 мл).
Что наблюдаете в каждой пробирке? Составьте уравнения реакций получения ацетилена, окисления ацетилена бромной водой и подкисленным раствором перманганата калия, а также получения ацетиленида серебра. Сделайте вывод о качественных реакциях алкенов и алкинов.
48
4. Свойства ароматических углеводородов
а) Растворимость бензола
Налейте в одну пробирку 1–2 мл воды, в другую – 1–2 мл этилового спирта. В обе пробирки добавьте по 5–10 капель бензола. Встряхните пробирки. Сделайте вывод о растворимости бензола в органических и неорганических растворителях.
б) Отличие ароматических углеводородов от алифатических
В три пробирки налейте по 1–2 мл хлороформа СНCl3, высушенного над хлоридом кальция. В первую пробирку добавьте 2–3 капли бензола, во вторую – 2–3 капли гексана, в третью – 2–3 капли раствора нафталина. Тщательно перемешайте содержимое пробирок, слегка наклоняя их, чтобы смочить стенки пробирки. В каждую пробирку добавьте 0,5–0,6 г хлорида алюминия таким образом, чтобы часть порошка попала на стенки пробирки. Наблюдайте изменение окраски раствора и порошка на стенке пробирки. Напишите уравнения возможных реакций.
в) Нитрование ароматических углеводородов
Налейте в одну пробирку 5–7 капель бензола, в другую – столько же толуола. В обе пробирки внесите по 10–15 капель нитрующей смеси (смесь концентрированной серной и азотной кислот). Пробирки осторожно встряхивайте в течение 3 мин.
Затем вылейте содержимое каждой пробирки в стаканчик с водой. Что наблюдаете? Каким запахом обладают полученные вещества? Составьте уравнения реакций нитрования бензола и толуола. Смесь каких двух веществ получается при нитровании толуола? Как протекают реакции электрофильного замещения у гомологов бензола? В выводе покажите возможные способы получения предельных и непредельных углеводородов. Сравните их химическую активность.
49
Кислородсодержащие органические соединения
Цель работы: изучить некоторые физические и химические свойства предельных кислородсодержащих органических соединений (спиртов, альдегидов, кетонов и кислот).
1. Свойства спиртов и фенолов
а) Взаимодействие с активными металлами
Впробирку с 0,5–1 мл безводного этилового спирта бросьте кусочек натрия, высушенного фильтровальной бумагой. Подожгите выделяющийся газ. Когда весь натрий прореагирует, перенесите раствор в фарфоровую чашку и осторожно выпарите избыток спирта. К остатку в чашке прилейте немного воды и несколько капель фенолфталеина. Что наблюдаете? Составьте уравнения реакции получения и гидролиза этилата натрия.
б) Получение хлорэтана
Впробирку с газоотводной трубкой поместите 0,1 г хлорида натрия и прилейте 3 мл смеси этилового спирта и концентрированной серной кислоты (2 мл этилового спирта и 1 мл серной кислоты). Присоединив отводную трубку, пробирку закрепите наклонно
влапке штатива и очень осторожно нагревайте. Выделяющийся хлорэтан подожгите, он горит характерным зеленым пламенем. Напишите уравнения реакции получения хлорэтана.
в) Окисление этилового спирта перманганатом калия
Всухой цилиндр налейте 1–2 мл концентрированной серной кислоты и осторожно, стараясь не смешивать жидкости, по стенке прилейте 1–2 мл этилового спирта. Внесите в пробирку несколько
кристалликов сухого перманганата калия. При оседании KMnO4 на границе кислота-спирт наблюдаются яркие вспышки. Объясните наблюдаемое явление. Напишите уравнение реакции окисления этилового спирта, имея в виду образующийся при этом уксусный альдегид, способный весьма легко окисляться в условиях реакции до уксусной кислоты. Подберите коэффициенты методом ионноэлектронного баланса.
50
