
Индивидуальные задания по физической химии
..pdf
3. Вычислите равновесное количество вещества В при
Р= 3·104 Па и Т = 300 К.
4.Рассчитайте степень превращения веществ А и Б при
Т = 300 К.
Пример 1.1. Истинная молярная теплоемкость серебра в интервале температур от 273 до 1234 К выражается уравнением (см. прил. 1), Дж/(моль·К):
CP0 = 23,97 + 5,27 10–3 Т – 0,25 105 Т –2.
Вычислите среднюю молярную теплоемкость серебра СP в интервале от 298 до 700 К.
Решение. Среднюю теплоемкость в данном интервале температур рассчитывают по уравнению
|
|
Q |
1 |
T2 |
|
|
|
0 |
|||
CР |
|
|
|
CРdT, |
|
T T |
T T |
||||
2 1 |
|
2 1 T |
|||
|
|
|
|
|
1 |
где Q – количество теплоты, подведенной к системе.
С учетом зависимости истинной теплоемкости от температуры:
CP0 = а + bT + c'T –2,
получим выражение:
|
Р a b |
(T T ) |
c' |
. |
||
C |
||||||
|
||||||
2 |
1 2 |
T T |
||||
|
|
|
1 |
2 |
|
|
Подставляя коэффициенты a, b, c' и температуру из условия задачи, получаем:
|
|
5,27 10 3 |
|
0,25 105 |
|
||
CР 23,97 |
(298 700) |
|
|||||
2 |
298 |
700 |
|||||
|
|
|
|
||||
23,97 2,63 0,12 26,48 мольДж К.
11
Пример 1.2. Выведите функциональную зависимость изменения молярной изобарной теплоемкости от температуры
CP0 = f(T) для реакции
С(графит) + CO2(г) = 2CO(г).
Вычислите тепловой эффект реакции при 500 К, если при стандартных условиях он равен 172,5 кДж.
Решение. Зависимость CP0 реагирующих веществ от темпе-
ратуры представлена для неорганических веществ уравнениями вида
CP0 = a + bT + c'T –2,
поэтому величину CP0 рассчитывают по уравнению
CP0 = a + bT + c'T –2.
Выпишем температурные коэффициенты в уравнениях теплоемкости для веществ, участвующих в реакции (см. прил. 1):
|
Коэффициенты уравнения CP0 = f (T), |
Дж |
|
||
Вещество |
моль К |
|
|||
|
|
|
|
||
|
а |
b 103 |
|
с' 10–5 |
|
С(графит) |
16,86 |
4,77 |
|
–8,54 |
|
СО (г) |
28,41 |
4,10 |
|
–0,46 |
|
СО2 (г) |
44,14 |
9,04 |
|
–8,53 |
|
Вычислим их изменения:
a = 2·28,41 – 44,14 – 16,86 = –4,18;
b = (2·4,10 – 9,04 – 4,77)·10–3 = –5,61·10–3;
c' = 2·(–0,46) – ( 8,53) – ( 8,54) ·105 = 16,15·105.
Функциональная зависимость изменения молярной изобарной теплоемкости от температуры дляданнойреакцииимеет вид:
CP0 = –4,18 –5,61.10–3T + 16,15.105T –2.
12
Для расчета теплового эффекта реакции воспользуемся уравнением Кирхгофа в интегральной форме:
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НT02 |
H1 СP0 dT . |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
После |
подстановки |
зависимости |
CP0 |
от |
T в |
уравнение |
|||||||||||
Кирхгофа и интегрирования получим: |
|
|
|
|
|
|
|
|
|
||||||||
НT0 HT0 |
a T2 T1 b T22 |
T12 c' |
1 |
|
1 |
; |
|||||||||||
|
|
|
|
||||||||||||||
T |
T |
||||||||||||||||
2 |
|
1 |
|
|
|
|
2 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
||||
H5000 172,5 103 4,18 500 298 |
5,61 10 3 5002 |
2982 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
16,15 10 |
5 |
1 |
|
|
1 |
|
173400 Дж. |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
298 |
500 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Пример 1.3. Пристандартныхусловиях для реакции |
|
||||||||||||||||
|
|
|
|
|
С(графит) + CO2(г) = 2CO(г) |
|
|
|
|
|
|
|
|||||
изменение энтропии |
S2980 = 175,46 |
|
Дж |
. Используя функ- |
|||||||||||||
моль К |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
циональную зависимость теплоемкостей реагирующих веществ оттемпературы (см. пример 1.2), вычислите изменение энтропии
SТ0 при температуре500 К.
Решение. Изменение энтропии реакции при заданной температуре находим по уравнению
ST0 S2980 |
T |
CP0 dT . |
|
298 |
T |
После подстановки CP0 = a + bT + c'T –2 и интегрирования получим:
|
0 |
|
0 |
|
T |
b T 298 |
1 |
|
1 |
|
1 |
|
|
S |
Т |
S |
298 |
a ln |
|
|
c' |
|
|
|
. |
||
298 |
2 |
2982 |
T 2 |
||||||||||
|
|
|
|
|
|
|
13

Значения a, b и c' рассчитаны в примере 1.2. Отсюда:
S5000 175,46 4,18ln 500298 5,61 10 3 (500 298)1216,15 105 2981 2 5001 2 178,03 мольДж К.
Пример 1.4. Константа равновесия KP газовой реакции А + Б = В равна 0,128·105 Па–1. Определите состав равновесной смеси (в мол. %), полученной при давлении Р = 10,13·105 Па из 2 моль вещества А и 1 моль вещества Б.
Решение. Обозначим через x равновесное количество вещества В. Так как на образование его должно израсходоваться согласно химическому уравнению реакции по x молей А и Б, то в равновесной смеси останется (2 – x) моль А и (1 – x) моль Б. Запишем количество вещества
|
А + |
Б |
= В |
в исходной смеси |
2 |
1 |
0 |
в равновесной смеси |
(2 – x) |
(1 – x) |
x |
Отсюда ∑ ni = 2 – x + 1 – x + x = 3 – x.
Парциальные давления компонентов рассчитываем по уравнению
Pi = Xi·P,
где Xi – мольная доля i-го компонента газовой смеси, Xi = nini ;
P – общее давление в системе.
Выражения для парциальных давлений компонентов име-
ют вид: |
|
|
|
|
|
|
|
PA = |
(2 x) |
P ; PБ = |
(1 x) |
P ; PВ = |
x |
P . |
|
(3 x) |
(3 x) |
(3 x) |
|||||
|
|
|
|
Подставим эти выражения в уравнение для константы равновесия реакции:
14

KP = |
PВ |
|
x(3 x) |
|
1 |
= 0,128·10 |
5 |
–1 |
|
|
|
|
|
|
Па . |
||||
P |
P |
(2 x)(1 x) |
10,13 105 |
|
|||||
|
A |
Б |
|
|
|
|
|
|
|
После небольших преобразований получим: 2,32 x2 – 6,96 x + 2,64 = 0.
Решая квадратное уравнение, находим: x1 = 0,44; x2 = 2,55. Второй корень не имеет физического смысла, так как x может быть только меньше 1. Остается значение x = 0,44. Следовательно, в равновесной смеси содержится 2 – 0,44 = 1,56 моль А; 1 – 0,44 = 0,56 моль Б и 0,44 моль В. Состав смеси в мольных
процентах определяется из соотношения
Xi = nini ·100 %,
где ∑ ni = 1,56 + 0,56 + 0,44 = 2,56.
Определим состав равновесной смеси:
XA = 1,562,56 100 60,94 % ;
XБ = 0,562,56 100 21,88 % ;
XВ = 0,442,56 100 17,18 % .
Модуль 2. ТЕРМОДИНАМИКА РАСТВОРОВ. ФАЗОВЫЕ РАВНОВЕСИЯ
Задание 2.1. Определение фазового равновесия в однокомпонентных системах. Построение диаграмм
состояния однокомпонентных систем
Используя зависимости давления насыщенного пара данного вещества от температуры и плотности в твердом (т) и жидком (ж) состояниив тройной точке, выполнитеследующиезадания:
15

1.Постройте графики зависимостей P = f (T) и lnP = f 1 ,
T
обозначьте поля, соответствующие твердому, жидкому и газообразному состояниям вещества.
2. Определите по графикам координаты тройной точки.
3. Рассчитайте средние теплоты испарения H исп и возгон-
ки H возг .
4.Определите теплоты испарения, возгонки и плавления вещества при температуре тройной точки.
5.Определите приближенно температуру кипения вещества при нормальном давлении и проверьте применимость правила Трутона.
6.Вычислите температуру плавления вещества молярной массой М при давлении Р.
Необходимые данные для расчета возьмите в табл. 4.
|
|
|
|
|
Таблица 4 |
|
|
|
|
|
|
|
|
Номер |
Твердое состояние |
Жидкое состояние |
Условия |
|||
варианта |
Т, К |
Р, Па |
Т, К |
Р, Па |
||
|
||||||
1 |
268,2 |
401,2 |
269,2 |
505 |
M = 18 г/моль |
|
|
269,2 |
437,2 |
271,2 |
533,2 |
P = 40,5 105 Па |
|
|
270,2 |
475,9 |
273,2 |
573 |
(т) = 918 кг/м3 |
|
|
271,2 |
517,2 |
275,2 |
656 |
(ж) = 1000 кг/м3 |
|
|
272,2 |
553,2 |
278,2 |
760 |
|
|
|
|
|
283,2 |
982 |
|
|
|
248 |
|
299,2 |
1600 |
|
|
2 |
7998 |
260 |
23330 |
M = 27 г/моль |
||
|
254,4 |
13300 |
265 |
27190 |
P = 800 105 Па |
|
|
258 |
17995 |
270 |
31860 |
(т) = 718 кг/м3 |
|
|
259 |
19995 |
278 |
40290 |
(ж) = 709 кг/м3 |
|
|
260 |
23327 |
282 |
47990 |
|
|
3 |
377 |
7064 |
373 |
10662 |
M = 254 г/моль |
|
|
381 |
8531 |
388 |
12397 |
P = 200 105 Па |
|
|
383 |
9331 |
392 |
13997 |
(т) = 3960 кг/м3 |
|
|
386 |
10397 |
393 |
14796 |
(ж) = 3900 кг/м3 |
|
|
389 |
11997 |
397 |
16929 |
|
|
|
392 |
13997 |
401 |
19462 |
|
|
16 |
|
|
|
|
|
|
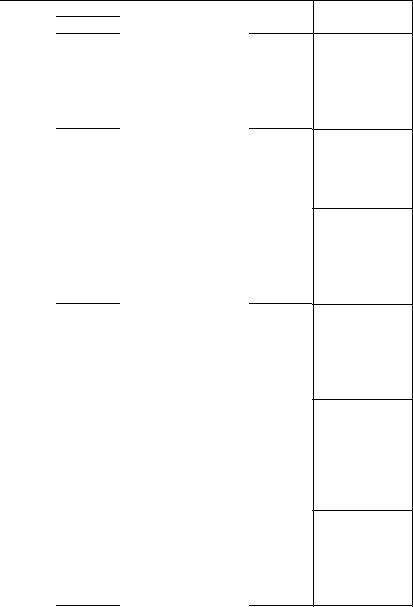
Продолжение табл. 4
Номер |
Твердое состояние |
Жидкое состояние |
||
варианта |
Т, К |
Р, Па |
Т, К |
Р, Па |
4 |
418 |
133,3 |
490,5 |
5332 |
|
446,5 |
667,0 |
504,8 |
8020 |
|
460,2 |
1333,0 |
523,0 |
13300 |
|
475 |
2666,0 |
552,0 |
26660 |
|
490,5 |
5332,0 |
583 |
53320 |
|
|
|
612 |
101308 |
5 |
223 |
133 |
244 |
1200 |
|
237 |
466,5 |
253 |
1319 |
|
246 |
799,8 |
270 |
2465 |
|
252 |
1213 |
282 |
3865 |
|
253 |
1319 |
286 |
4398 |
6 |
423,5 |
23994 |
446,4 |
47000 |
|
433,2 |
31325 |
448,2 |
47454 |
|
437,7 |
35324 |
451,2 |
49987 |
|
441,2 |
39323 |
460 |
55986 |
|
444,2 |
43322 |
470 |
63317 |
|
448,2 |
47454 |
480 |
71345 |
7 |
334,6 |
266,6 |
348,2 |
1046 |
|
338,4 |
352 |
353,7 |
1266 |
|
343,2 |
533 |
358,2 |
1399 |
|
348,2 |
733 |
363,8 |
1666 |
|
353,2 |
1040 |
368,8 |
2066 |
|
353,7 |
1266 |
373,8 |
2466 |
8 |
205,2 |
16796 |
219,2 |
55319 |
|
208 |
19195 |
224,2 |
59985 |
|
209,2 |
22662 |
226,7 |
66650 |
|
213,2 |
29859 |
229,2 |
75981 |
|
216,4 |
35991 |
231,2 |
83979 |
|
220 |
45988 |
232,7 |
87975 |
|
224,2 |
59985 |
|
186,6 |
9 |
353 |
40 |
363 |
|
|
363 |
80 |
393 |
680 |
|
373 |
187 |
395 |
733 |
|
383 |
393 |
400,7 |
973 |
|
393 |
680 |
403,7 |
1133 |
|
|
|
408,7 |
1400 |
Условия
M = 174 г/моль
P = 220 105 Па
(т) = 954 кг/м3(ж) = 948 кг/м3
M = 154 г/моль
P = 60,8 105 Па(т)= 1680 кг/м3(ж) = 1650 кг/м3
M = 152 г/моль
P = 600 105 Па
(т) = 985 кг/м3(ж) = 977 кг/м3
M = 127,5 г/моль
P = 180 105 Па(т) = 1145 кг/м3(ж) = 982 кг/м3
M = 12,5 г/моль
P = 500 105 Па(т) = 72970 кг/м3(ж) = 2850 кг/м3
M = 122 г/моль
P = 850 105 Па(т) = 1105 кг/м3(ж) = 1095 кг/м3
17
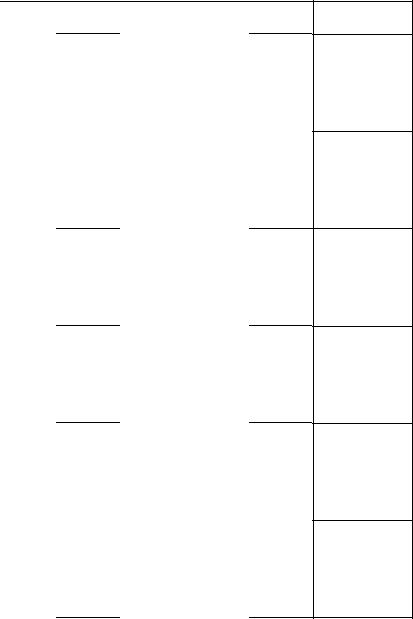
Продолжение табл. 4
Номер |
Твердое состояние |
Жидкое состояние |
||
варианта |
Т, К |
Р, Па |
Т, К |
Р, Па |
10 |
272,5 |
3332 |
275,7 |
4879 |
|
274,2 |
3599 |
280,2 |
5599 |
|
275,7 |
4066 |
281,7 |
5799 |
|
277,2 |
4399 |
283,3 |
6199 |
|
279,2 |
5065 |
285,2 |
6932 |
|
281,7 |
5799 |
287,5 |
7731 |
11 |
99 |
10675 |
111 |
63984 |
|
102 |
13995 |
115,5 |
68649 |
|
103 |
17330 |
117 |
72782 |
|
104,5 |
19995 |
118 |
77980 |
|
107,2 |
26660 |
119 |
82646 |
|
115,5 |
68649 |
119,6 |
87711 |
12 |
177 |
15996 |
180 |
26660 |
|
180 |
19995 |
185,5 |
32992 |
|
182 |
23994 |
188 |
37057 |
|
184 |
28659 |
191 |
43456 |
|
185,5 |
32992 |
194 |
51987 |
|
223 |
|
197 |
59985 |
13 |
133 |
244 |
1200 |
|
|
237 |
466,5 |
253 |
1319 |
|
246 |
799,8 |
270 |
2465 |
|
252 |
1213 |
282,5 |
3865 |
|
253 |
1319 |
285,7 |
4398 |
|
423,5 |
|
|
47000 |
14 |
23994 |
446,4 |
||
|
433,2 |
31325 |
448,2 |
47454 |
|
437,7 |
35324 |
451,2 |
49987 |
|
441,2 |
39323 |
460 |
55986 |
|
444,2 |
43322 |
470 |
63317 |
|
448,2 |
47454 |
480 |
71345 |
15 |
273 |
3266 |
274 |
3730 |
|
274 |
3466 |
275 |
4000 |
|
276 |
3932 |
276 |
4160 |
|
277 |
4306 |
278 |
4530 |
|
278 |
4530 |
283 |
6050 |
|
|
|
290 |
8930 |
Условия
M = 84 г/моль
P = 120 105 Па
(т) = 796 кг/м3(ж) = 788 кг/м3
M = 783,5г/моль P = 800 105 Па(т) = 3330 кг/м3(ж) = 2150 кг/м3
M = 81 г/моль
P = 300 105 Па(т) = 1626 кг/м3(ж) = 1610 кг/м3
M = 154 г/моль
P = 60,8 105 Па(т) = 1680 кг/м3(ж) = 1650 кг/м3
M = 152 г/моль P = 600 105 Па
(т) = 985 кг/м3(ж) = 977 кг/м3
M = 78 г/моль
P = 900 105 Па
(т) = 893 кг/м3(ж) = 890 кг/м3
18
Продолжение табл. 4
Номер |
Твердое состояние |
Жидкое состояние |
||
варианта |
Т, К |
Р, Па |
Т, К |
Р, Па |
16 |
248 |
7998 |
260 |
23330 |
|
254,4 |
13300 |
265 |
27190 |
|
258 |
17995 |
270 |
31860 |
|
259 |
19995 |
278 |
40290 |
|
260 |
23327 |
282 |
47990 |
17 |
131 |
1333 |
137 |
6665 |
|
135 |
1999,5 |
141 |
7331,5 |
|
137 |
2666 |
145 |
8664,5 |
|
139,2 |
3999 |
146 |
9997,5 |
|
141,5 |
5332 |
149 |
12663 |
|
144 |
7998 |
151,4 |
15996 |
|
146 |
9997,5 |
|
4665 |
18 |
183 |
333 |
201 |
|
|
188 |
587 |
204 |
5305 |
|
196 |
1850 |
214 |
7198 |
|
199 |
3000 |
216 |
7998 |
|
204 |
5305 |
230 |
13328 |
|
|
|
244 |
21728 |
19 |
242 |
1333 |
293 |
26660 |
|
252,4 |
2666 |
303 |
37724 |
|
263,8 |
5332 |
308 |
46188 |
|
271 |
7998 |
311 |
51720 |
|
281 |
13330 |
313 |
56186 |
|
293 |
26660 |
316 |
63317 |
20 |
1758 |
22,66 |
1832 |
187 |
|
1788 |
63,98 |
1873 |
300 |
|
1810 |
99,97 |
1905 |
387 |
|
1835 |
115,99 |
1938 |
486 |
|
1873 |
300,00 |
1956 |
573 |
|
|
|
1991 |
800 |
|
|
|
2040 |
973 |
21 |
230 |
26260 |
236 |
63315 |
|
233 |
31458 |
246 |
78647 |
|
237 |
39990 |
248 |
83979 |
|
240 |
49987 |
249 |
86645 |
|
243 |
58518 |
252,5 |
96942 |
|
245 |
66650 |
253,5 |
100508 |
|
249 |
86645 |
|
|
Условия
M = 27г/моль
P = 800 105 Па
(т) = 718 кг/м3(ж) = 709 кг/м3
M = 68 г/моль
P = 300 105 Па
(т) = 1450 кг/м3(ж) = 1434 кг/м3
M = 64 г/моль
P = 1000 105 Па
(т) = 1600 кг/м3(ж) = 1560 кг/м3
M = 58 г/моль
P = 700 105 Па
(т) = 822 кг/м3(ж) = 812 кг/м3
M = 52,5 г/моль P = 500 105 Па
(т) = 6800 кг/м3(ж) = 6750 кг/м3
M = 52 г/моль
P = 350 105 Па
(т) = 3010 кг/м3(ж) = 2955 кг/м3
19
Продолжение табл. 4
Номер |
Твердое состояние |
Жидкое состояние |
||
варианта |
Т, К |
Р, Па |
Т, К |
Р, Па |
22 |
276,6 |
1413 |
277,2 |
1826 |
|
278 |
1706 |
279 |
2052 |
|
279 |
1879 |
281,4 |
2372 |
|
280 |
2066 |
283,2 |
2626 |
|
281 |
2319 |
285 |
2932 |
|
196 |
|
288,7 |
3279 |
23 |
101325 |
212 |
592751 |
|
|
203 |
190491 |
220 |
648480 |
|
213 |
402360 |
223 |
674824 |
|
220 |
648480 |
239 |
1005114 |
|
|
|
241 |
1065237 |
|
173 |
|
242 |
1131722 |
24 |
7330 |
190 |
31192 |
|
|
178 |
11600 |
196 |
38657 |
|
183 |
16795 |
200 |
46655 |
|
184 |
19995 |
207 |
55986 |
|
190 |
31192 |
215 |
69476 |
|
229,2 |
|
221 |
77314 |
25 |
133,3 |
273,2 |
4786 |
|
|
248 |
694,5 |
282,5 |
6665 |
|
257 |
1333 |
298,2 |
12697 |
|
267,2 |
2966 |
306,7 |
16396 |
|
273,2 |
4786 |
312,5 |
18929 |
|
100 |
|
316,5 |
21328 |
26 |
4132 |
105 |
17329 |
|
|
104 |
8531 |
112 |
29659 |
|
107 |
14663 |
114 |
34738 |
|
109 |
19995 |
115 |
38657 |
|
110,5 |
25367 |
116 |
46435 |
|
112 |
29653 |
117 |
53053 |
27 |
55 |
1333 |
60 |
12663 |
|
58 |
3999 |
64 |
17329 |
|
59,2 |
11997 |
66 |
22394 |
|
63 |
14663 |
67,8 |
27993 |
|
64 |
17329 |
69 |
31992 |
|
|
|
71 |
39990 |
Условия
M = 46 г/моль
P = 950 105 Па(т) = 1240 кг/м3(ж) = 1290 кг/м3
M = 44 г/моль
P = 750 105 Па(т) = 1542 кг/м3(ж) = 1510 кг/м3
M = 34 г/моль
P = 450 105 Па(т) = 1010 кг/м3(ж) = 980 кг/м3
M = 32 г/моль
P = 300 105 Па
(т) = 837 кг/м3(ж) = 825 кг/м3
M = 30 г/моль
P = 900 105 Па
(тв) = 1272 кг/м3(ж) = 1260 кг/м3
M = 28 г/моль
P = 500 105 Па(т) = 1026 кг/м3(ж) = 808 кг/м3
20
