
3844
.pdf
20
Пример 1. Считая диссоциацию хлороводородной кислоты в воде полной, вычислите рН 0,01 М раствора HCl.
Решение. Концентрация ионов водорода в растворе равна концентрации хлороводородной кислоты
с(Н+) = 0,01 моль/дм3, рН = - lg c(H+), рН = - lg 1 ∙10-2 = 2.
Пример 2. Рассчитать рН 0,56% раствора гидроксида калия (ρ = 1 г/см3). Решение. Определяем молярную концентрацию 0,56% раствора
КОН по формуле 4.11. |
|
|
|
|
с(КОН) |
0,56 1 10 |
0,1 моль / дм3 |
, |
|
|
||||
56 |
||||
|
|
|
рОН = - lg c(OH-) = - lg 0,1 = 1,
рН = 14 – рОН = 14 -1 = 13.
Слабые кислоты и основания диссициациируют в растворе мало.
HA + H2O = H3O+ + A-.
Можно считать, что с(НА) = [HA], и [H+] = [A-], тогда выражение константы кислотности Ка принимает следующий вид:
|
|
|
[H ][A ] |
|
|
|
[H ]2 |
|
|
|
||||||||||||||
|
|
K a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
||
|
|
[HA] |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
c(HA) |
|
|
|
|||||||||||||
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
pK a |
1 |
lg c(HA) . |
|
|||||
[H ] K a c(HA) |
|
|
и |
pH |
|
|
(5.5) |
|||||||||||||||||
2 |
2 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Аналогично, допуская, что в растворе слабого основания |
||||||||||||||||||||||||
единственным источником OH- – ионов может быть равновесие |
|
|||||||||||||||||||||||
|
|
В + Н2О = ВН+ + ОН-, |
|
|
|
|||||||||||||||||||
получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
[OH-] = K в с(В), (где Кв – константа основности) |
|
|||||||||||||||||||||||
|
|
рОН |
|
1 |
|
pK |
|
1 |
lg c(B), |
|
|
|
||||||||||||
|
|
2 |
в |
2 |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
или рН 14 |
|
|
|
1 |
pK в |
|
|
|
1 |
lg c(B). |
|
|
(5.6) |
|||||||||||
2 |
2 |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Значения рКa и pKв приведены в Приложении 1.
Пример 3. Рассчитайте рН 0,01 М раствора уксусной кислоты.
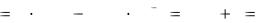
21
Решение. Показатель константы кислотности рКа уксусной кислоты согласно справочным данным равен 4,76.
Решение проводим по формуле 5.5.
рН |
1 |
4,76 |
1 |
lg1 10 2 |
2,38 1 3,38. |
|
2 |
2 |
|||||
|
|
|
|
5.1.Рассчитать рН 0,01 М раствора HNO3.
5.2.Рассчитать рН 0,02 М раствора NaOH.
5.3.Рассчитать рН 0,36% раствора HCl (ρ = 1 г/см3).
5.4.Рассчитать рН 0,6% раствора уксусной кислоты (ρ = 1 г/см3).
5.5.Рассчитать рН 0,17% раствора аммиака (ρ = 1 г/см3).
5.6.Рассчитать рН 0,5% раствора аммиака (ρ = 0,996 г/см3).
5.7.Рассчитать рН 0,6% раствора гидроксида натрия (ρ = 1,005 г/см3).
5.8.Рассчитать рН водного раствора, 200 см3 которого содержат 4,0 г гидроксида натрия.
5.9.Рассчитать рН водного раствора, 100 см3 которого содержат 0,56г гидроксида калия.
5.10.Рассчитать рН 0,02 М раствора HClO4.
5.11.Рассчитать рН раствора ,1 дм3 которого содержит 5,6 г гидроксида калия.
5.12.Рассчитать рН 0,05 М раствора HNO3.
5.13.Рассчитать рН 0,01 М раствора NH4OH.
5.14.Рассчитать рН 1% раствора хлорной кислоты HClO4 (ρ = 1,005 г/см3).
5.15.Рассчитать рН 0,3% раствора уксусной кислоты (ρ = 1 г/см3).
5.16.Рассчитать рН раствора молочной кислоты HC3H5O3 с концентрацией 0,01 моль/дм3.
5.17.Рассчитать рН раствора бензойной кислоты C6H5COOH с концентрацией 0,1 моль/дм3.
5.18.Рассчитать рН раствора муравьиной кислоты HCOOH, с концентраций 0,02 моль/дм3.
5.19.Рассчитать рН 0,02 М раствора LiOH.
5.20.Рассчитать рН 0,05 М раствора NaOH.
5.21.Рассчитать рН 0,03 М раствора КОН.
22
5.22.Рассчитать рН водного раствора, 100 см3 которого содержат 2г гидроксида натрия.
5.23.Рассчитать рН раствора, 2 дм3 которого содержат 0,2 моль HCl.
5.24.Рассчитать рН 0,15% раствора уксусной кислоты (ρ = 1 г/см3).
5.25.Рассчитать рН 0,34% раствора аммиака (ρ = 1 г/см3).
Тема 6. Гидролиз солей
Для предложенных водных растворов солей Вашего варианта определите возможность протекания реакции гидролиза. Необходимо вспомнить, что реакция между ионами соли и водой протекает только в том случае, если образуются слабые (в том числе малорастворимые) электролиты (см. Приложение 4). Это приводит к смещению равновесия в диссоциации воды и, следовательно, к изменению рН среды. Таким образом, чтобы выполнить это задание, надо знать сильные и слабые кислоты и основания, а также шкалу рН в водных растворах. Соли, образованные сильной кислотой и сильным основанием, не приводят к смещению равновесия и изменению рН среды.
В случае протекания реакции гидролиза запишите соответствующие уравнения реакции, определите тип гидролиза (по катиону или аниону) и определите реакцию среды (рН >7; рН = 7; рН<7).
1.Bi(NO3)3, KCl, K2SO4, BaCl2, Na2SO3.
2.KJ, Na2HPO4, SnCl2, NaCl, NaNO3.
3.MgCl2, FeCl2, Na2S, Na2SO4, NaCl.
4.K2CO3, NaBr, AlCl3, KCl, Ba(CH3COO)2.
5.KJ, Fe(NO3)3, Ca(NO3)2, NH4NO3, NH4NO2.
6.LiCl, Ca(CH3COO)2, Na2SO4, BaCl2, (NH4)2SO4.
7.Na2SO4, (NH4)2SO4, Al2(SO4)3, Na2SO3, NaNO3.
8.NH4NO2, CaCl2, KCl, NaNO3, KCN.
9.Na2SO3, K2SO4, K2S, NaNO3, FeCl3.
10.Ba(NO3)2, FeCl3, NaBr, K2SO4, (NH4)2S.
11.Na2SO4, Na2CO3, (NH4)2CO3, KJ, SnCl2.
12.K2SO3, BiCl3, NH4Cl, KJ, NaNO3.
13.K2S, KCl, KCH3COO, MgSO4, NaNO3.
23
14.CuCl2, NH4NO3, CaCl2, NaBr, Na2S.
15.NaNO2, NH4Cl, KNO3, BaCl2, FeSO4.
16.NaH2PO4, KBr, Sn(NO3)2, KCl, NaNO3.
17.Na2CO3, Fe(NO3)3, CuSO4, NaBr, CaCl2.
18.Na2S, NH4NO3, K2SO3, NaCl, K2SO4.
19.KBr, NH4CH3COO, K2S, K2SO4, Mg(NO3)2.
20.(NH4)2S, NaCl, Na2SO3, K2SO4, CaCl2.
21.BiCl3, KCl, NaNO3, Na2HPO4, Na2S.
22.(NH4)2SO4, Na3PO4, KNO3, KBr, FeCl3.
23.SnCl2, Na2S, NaBr, NaNO2, K2SO4.
24.NaCl, CuCl2, KJ, Na2SO3, Fe2(SO4)3.
25.Ni(NO3)2, BaCl2, K2SO4, Na2HPO4, NaCl.
Тема 7. Малорастворимые электролиты
Задания по этой теме представлены в виде задач, для решения которых необходимо знать правило произведения растворимости и растворимость малорастворимых электролитов с ионным типом кристаллической решетки.
Осадок малорастворимого электролита выпадает, если произведение концентрации его ионов (ПИ) в растворе больше произведения растворимости (ПР). Значения ПР приведены в Приложении 2.
Пример 1. Выпадет ли осадок AgCl при сливании равных объемов
0,01 М раствора AgNO3 и 0,02 М раствора NaCl? ПР(AgCl) = 1,78 ∙ 10-10.
Решение. При сливании равных объемов общий объем раствора увеличивается вдвое, следовательно, первоначальная концентрация ионов уменьшается вдвое. Находим произведение концентрации ионов, образующих малорастворимое соединение.
Ag+ + Cl- = AgCl↓
ПИ = [Ag+] [Cl-] = 5 ∙ 10-3 ∙ 1 ∙ 10-2 = 5 ∙10-5. полученное ионное произведение больше произведения растворимости, следовательно, осадок выпадет.
Взаимосвязь произведения растворимости (ПР) с растворимостью (Р) в моль/дм3 для электролита АmBn выражается формулой
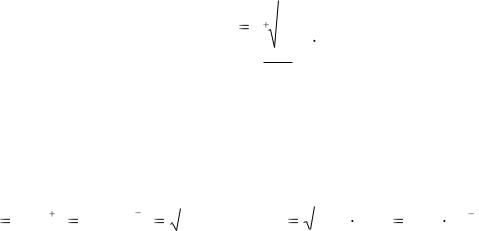
24
|
m n |
|
ПР AmBn |
|
|
||||
РAmBn |
m |
m |
n |
n . |
|||||
|
|
||||||||
|
|
|
|
|
|
|
|||
Для бинарных электролитов Р = 
 ПР.
ПР.
Растворимость в г/дм3 (Р') находят по формуле P' = P ∙ M.
Пример 2. Какова растворимость оксалата кальция, если ПР(CaC2O4)
= 2,29 ∙ 10-5?
Решение
|
|
|
2 |
|
|
|
|
|
|
|
|
|
P |
[Ca 2 ] [C |
O |
] |
ПР(CaC |
O |
4 |
) |
|
|
2,29 10-9 4,78 10 5. |
||
CaC2O4 |
2 |
|
4 |
|
2 |
|
|
|
|
|
|
|
Для выражения |
растворимости |
|
в |
г/дм3 полученное значение |
||||||||
умножают на молярную массу соли:
Р' = 4,78 ∙ 10-5 моль/дм3 ∙ 128,1 г/моль = 6,12 ∙ 10-3г/дм3.
7.1.Каким из реагентов: NaCl, KJ или NaBr можно полнее осадить ион серебра из раствора его соли?
7.2.Образуется ли осадок PbCl2 при смешивании равных объемов 0,02 М
HCl и 0,01 М Pb(NO3)?
7.3.К раствору, содержащему ионы Fe2+, Mg2+ и Zn2+ в равных концентрациях, по каплям прибавляли раствор NaOH. Какой из малорастворимых гидроксидов образуется в первую очередь?
7.4.В насыщенном растворе какого из сульфидов CuS, PbS или ZnS будет меньше концентрация иона металла? Какой из перечисленных ионов будет осажден в виде сульфида наиболее полно?
7.5.Произведение растворимости (ПР) оксалата кальция CaC2O4 равно 2 ∙10-9. Найти растворимость этой соли.
7.6.Сколько граммов CaCO3 содержится в 2 дм3 насыщенного раствора?
7.7.На раствор, содержащий 0,2 моль/дм3 ионов Ba2+ и 0,01 моль/дм3 ионов Ca2+, подействовали раствором оксалата аммония (NH4)2C2O4. Какой из катионов будет осаждаться первым?
7.8.Растворимость AgJ равна 1,2 ∙ 10-8 моль/дм3. Вычислите произведение растворимости AgJ.
7.9.Сколько граммов PbSO4 можно растворить при 250С в 1 дм3 воды?
25
7.10.Пользуясь произведением растворимости AgCl и AgBr, определите, в каком из насыщенных растворов этих солей содержится больше ионов серебра?
7.11.Будет ли выпадать осадок CaSO4 при сливании равных объемов растворов 0,01 М CaCl2 и 0,1 М Na2SO4?
7.12.Вычислите произведение растворимости BaCO3, если его растворимость составляет 8,8 ∙ 10-3 г/дм3.
7.13.Растворимость AgNCS в воде при 250С составляет 8,38 ∙ 10-7 моль/дм3. Вычислить произведение растворимости при этих условиях.
7.14.Образуется ли осадок Ca(OH)2 при сливании равных объемов 0,01 М
CaCl2 и 0,02 М NaOH?
7.15.В какой последовательности будут осаждаться из раствора ионы CO32-, C2O42-, CrO42-, находящиеся в равных концентрациях, при добавлении раствора BaCl2?
7.16.При 250С в 500 см3 воды растворяется 1,63 ∙ 10-3 г BaCrO4. Чему равно при тех же условиях произведение растворимости этой соли?
7.17.Сколько граммов CaCO3 можно растворить при 250С в 2 дм3 воды?
7.18.Какова растворимость в г/дм3 PbSO4?
7.19.В насыщенном растворе какого электролита BaC2O4 или BaCrO4 содержится меньше ионов бария?
7.20.К раствору, содержащему ионы Ba2+ и Ca2+ в равных концентрациях, добавляли по каплям раствор (NH4)2C2O4. Какой из катионов будет осаждаться первым?
7.21.Пользуясь произведением растворимости BaCO3 и CaCO3, определите, в каком из насыщенных растворов этих солей больше содержится карбонатионов.
7.22.Сколько граммов BaCO3 содержится в 2 дм3 насыщенного раствора?
7.23.Образуется ли осадок BaSO4 при сливании 20 см3 0,005 М раствора BaCl2 и 20 cм3 0,001 М раствора H2SO4?
7.24.Какова растворимость в г/дм3 PbCl2?
7.25.К раствору, содержащему ионы Cl-, Br- и J- в равных концентрациях, по каплям прибавляли раствор AgNO3. Какой из перечисленных галогенидов серебра образуется в первую очередь?
26
Тема 8. Комплексные соединения
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений. В узлах кристаллической решетки таких соединений находятся комплексные ионы, способные к самостоятельному существованию в растворе, а в некоторых случаях и в газообразном состоянии.
Строение и свойства комплексных соединений объясняются координационной теорией А. Вернера.
В формуле комплекса [MLn] (молекула, ион) различают центральный атом – комплексообразователь (М) и лиганды (L). Название комплекс строится из названия лиганда с предшествующей числовой приставкой, указывающей число n лигандных групп, и названия центрального атома.
Названия анионных лигандов всегда имеют соединительную гласную – о,
например: |
|
F- - фторо, |
CN- - циано, |
Cl- - хлоро, |
NCS- - тиоцианато. |
OH- - гидроксо,
Некоторые нейтральные лиганды имеют специальные названия:
H2O – аква, |
NH3 – аммин, |
СO – карбонил, |
NO – нитрозил. |
Вкатионных комплексах вначале дается название аниона внешней сферы, затем комплексного катиона с указанием степени окисления комплексообразователя. Например, [Ag(NH3)2]Cl – хлорид диамминсеребра (I).
Ванионных комплексах называют комплексный анион, имеющий окончание –ат, с указанием степени окисления комплексообразователя, название которого образуют от латинского корня элемента, если таковой не совпадает с русским, затем называют катион. Например, K[Ag(CN)2] дицианоаргентат (I) калия.
Названия нейтральных комплексов составляют по общим правилам систематических названий неорганических веществ. Например, [Pt(NH3)2Cl2] – (NH3)2 дихлородиамминплатина (II).
27
В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды (1 частица) они подразделяются на монодентатные (dentate - зубчатый) и полидентатные. Например, NH3, Cl-, OH- являются монодентатными лигандами, этилендиамин H2N-CH2-CH2-NH2 – бидентатным. Би- и полидентатные лиганды при взаимодействии с комплексообразователем образуют замкнутые циклы. Комплексы с такими лигандами называют клешневидными, или хелатными. Например, при взаимодействии иона платины (II) с этилендиамином вокруг центрального атома замыкаются два пятичленных цикла, образуется заряженный хелат.
|
H2 |
H2 |
|
|
|
H2C — N |
N |
— CH2 |
2 + |
||
|
|||||
| |
|
Pt |
| |
|
|
H2C — N |
N |
— CH2 |
|
||
|
H2 |
H2 |
|
|
|
|
|
|
|
|
|
Ион бисэтилендиаминплатины (II).
В водных растворах комплексных соединений имеет место первичная диссоциация как сильного электролита (если комплексное соединение имеет внешнюю сферу) и вторичная диссоциация комплексной частицы как слабого электролита. Например, в хлориде диаммин серебра первичная диссоциация проходит как у любой соли на катион и анион.
[Ag(NH3 )2 ]Cl [Ag(NH3 )2 ]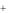 Cl .
Cl .
Затем комплексный ион по стадиям диссоциирует на составные части: центральный атом и лиганды. Каждая стадия описывается константой нестойкости (Кн).
[Ag(NH3 )2 ]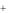 [Ag(NH3 )]
[Ag(NH3 )]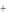 NH3 ,
NH3 ,
K |
|
[Ag(NH3 )] [NH3 ] |
, |
||
|
H(1) |
[Ag(NH3 )2 |
] |
|
|
|
|
|
|
||
[Ag(NH3 )] Ag
Ag NH3 ,
NH3 ,
K |
|
[Ag ][NH3 ] |
. |
|
H(2) |
[Ag(NH3 )] |
|
|
|
||
Суммарно этот процесс записывают так:
[Ag(NH3 )2 ] Ag
Ag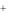 2NH3 ,
2NH3 ,

28
K H |
[Ag ][NH |
3 |
]2 |
. |
|
|
|
||||
[Ag(NH3 )2 |
] |
||||
|
|
||||
Назовите указанное в Вашем варианте комплексное соединение. Вычислите степень окисления и координационное число центрального атома – комплексообразователя. Напишите уравнение реакции диссоциации комплексного соединения как сильного электролита, затем – как слабого электролита. Составьте суммарное выражение для константы нестойкости комплексного иона.
8.1. [Co(NH3)5Cl]Cl |
8.10. [Hg(NH3)4]Cl2 |
8.19. [Co(NH3)5NO3]SO4 |
8.2. [Cr(H2O)6]Cl3 |
8.11. [Cd(NH3)4]SO4 |
8.20. [Pt(NH3)2Cl4] |
8.3. K[AuCl4] |
8.12. H[FeCl4] |
8.21. [Co(NH3)5SO4]Br |
8.4. (NH4)2[Co(NCS)4] |
8.13. K[Cr(OH)4] |
8.22. [Cu(NH3)4]SO4 |
8.5. Na2[Zn(OH)4] |
8.14. H3[SbCl6] |
8.23. [Pt(NH3)5OH]Br3 |
8.6. K[BiJ4] |
8.15. (NH4)2[Cu(NCS)4] |
8.24. K[Au(CN)2Cl2] |
8.7. K2[Cd(NO2)4] |
8.16. [Co(NH3)4](OH)3 |
8.25. K2[PtCl2(NO2)4] |
8.8. K[AgCl2] |
8.17. [Pb(NH3)]4Cl2]Br2 |
|
8.9. H2[SnCl6] |
8.18. K[Pt(NH3)Cl3] |
|
Тема 9. Смещение химического равновесия
В соответствии с принципом Ле-Шателье смещение химического равновесия в растворах возможно при изменении концентрации и температуры. Так, реакции гидролиза усиливаются при разбавлении раствора соли и нагревании; диссоциация слабой кислоты подавляется в присутствии сильного электролита, содержащего одноименный ион; комплексный ион разрушается, если его лиганды связываются в более слабый или малорастворимый электролит; малорастворимый электролит растворяется, если при действии реагента один из его ионов образует слабый электролит и т.п.
Пример 1. Как сместить равновесие вправо в системе
HCN = H+ + CN-.
Смесить равновесие вправо, то есть усилить диссоциацию слабой кислоты можно, связав ион водорода щелочью в еще более слабый электролит – воду.
H+ + OH- = H2O.
29
Пример 2. Как подавить гидролиз (то есть смесить равновесие влево) в реакции
Sn2+ + 2H2O = Sn(OH)2↓ + 2HCl.
Добавив ионы водорода (то есть кислоту), увеличим концентрацию продукта реакции, тем самым смесим равновесие влево.
Пример 3. Как смесить равновесие вправо в системе
[Ag(NH3)2]+ = Ag+ + 2NH3.
В данном случае из равновесия можно вывести ион серебра, связав его в малорастворимое соединение, например AgJ. Кроме того, аммиак можно связать в слабый электролит – NH4+ действием кислоты.
а) [Ag(NH3)2]+ + J- → AgJ↓ + 2NH3,
б) [Ag(NH3)2]+ + 2H+ → Ag++ 2NH4+.
Как сместить равновесие в равновесных системах
9.1. Сr3+ + 2H2O = CrO2- + 4H+. |
9.14. ZnO22- + 4H+ = Zn2+ + 2H2O. |
9.2. HCOOH = HCOO- + H+. |
9.15. CaSO3↓ = Ca2+ + SO32-. |
9.3. Cu2+ + 4NH3 = [Cu(NH3)4]2+. |
9.16. CH3COOH = CH3COO- + H+. |
9.4. [Al(OH)4] = Al3+ + 4OH-. |
9.17. NH4OH = NH4+ + OH-. |
9.5. FeCl3 + 3H3O = Fe(OH)3↓ + 3HCl. |
9.18. [Zn(OH)4]2- = Zn2+ + 4OH-. |
9.6. PbJ2↓ = Pb2+ + 2J- + ΔH. |
9.19. 2CrO42- + 2H+ = Cr2O72- + H2O. |
9.7. BiCl3 + 2H2O = Bi(OH)2Cl↓ + 2HCl. |
9.20. MgCO3↓ = Mg2+ + CO32-. |
9.8. CaCO3↓ = Ca2+ + CO32-. |
9.21. Al(OH)3↓ = Al3+ + 3OH-. |
9.10. Zn(OH)2↓ = Zn2+ + 2OH-. |
9.22. K2S + 2H2O = 2KOH + H2S↑. |
9.11. Sb3+ + 3H2O = Sb(OH)3 + 3H+. |
9.23. Co2+ + 6NCS- = [Co(NCS)6]4-. |
9.12. PbCl2↓ = Pb2+ + 2Cl- + ΔH. |
9.24. [Pb(OH)3]- = Pb2+ + 3OH-. |
9.13. [Co(NH3)4]2+ = Co2+ + 4NH3. |
9.25. Mg(OH)2↓ = Mg2+ + 2OH-. |
Тема 10. Окислительно-восстановительные реакции в растворах
Окислительно-восстановительные реакции в растворах сопровождаются переходом электронов от одних молекул или ионов к другим, что приводит к изменению степени окисления атомов, между которыми происходит такой переход. В окислительно-восстановительном процессе принимают участие две пары сопряженных окислителей и восстановителей. Для определения
