
2 семестр (+ подготовка к экзу) / Ответы на вопросы экзамена фх 2 семестр
.pdf
(см. вопрос 41)
Удельная электрическая проводимость элемента определяется числом ионов, находящихся в единице объема раствора, и скоростью их движения
В разбавленных растворах сильных электролитов диссоциация протекает полностью, поэтому количество ионов в единице объема соответствует концентрации электролита. Поскольку электростатические взаимодействия между ионами в таких растворах весьма невелики, то скорость движения ионов в них практически не меняется с изменение концентрации. Поэтому в разбавленных растворах сильных электролитов удельная электрическая проводимость почти линейно возрастает.
Далее кривые сильных электролитов проходят через максимум. В концентрированных растворах сильных электролитов увеличивается электростатическое взаимодействие, что приводит к снижению скорости движения ионов и к их ассоциации — образованию ионных двойников (ионных пар). В тепловом движении в растворе они выступают как единое целое и, следовательно, не переносят электрический ток.
Удельная электропроводимость слабых электролитов слабо зависит от концентрации. Незначительный прирост проводимости связан с увеличением числа ионов при увеличении концентрации раствора. Причиной снижения проводимости слабых электролитов при увеличении концентрации является снижение скорости ионов из-за увеличения вязкости раствора.
46.Молярная и эквивалентная электропроводности растворов электролитов. Связь эквивалентной электрической проводимости со скоростями движения и подвижностями ионов. Коэффициент электрической проводимости.
(см. вопрос 41)
В соответствии с гидродинамической теорией Стокса скорость ni (м/с) движения иона c радиусом ri в среде с динамической вязкостью h пропорциональна напряжённости внешнего электрического поля E:
Электрическая подвижность иона ui (м2/В∙с) – отношение скорости движения иона к напряжённости поля:
Подвижность иона численно равна скорости его движения при единичной напряжённости внешнего поля. Радиус иона в растворе – гидродинамический радиус или стоксовский радиус – это радиус сольватированного иона, он отличается от кристаллографического радиуса иона.
Эквивалентная ионная электропроводность пропорциональна подвижности иона:
Коэффициент пропорциональности – постоянная Фарадея – суммарный заряд 1 моль однозарядных частиц
Введём понятие коэффициента электрической проводимости
Величина коэффициента fL лежит в пределах 0 < fL < 1.
Разб. р-р слабого эл-та: |
Разб. р-р сильного эл-та: |
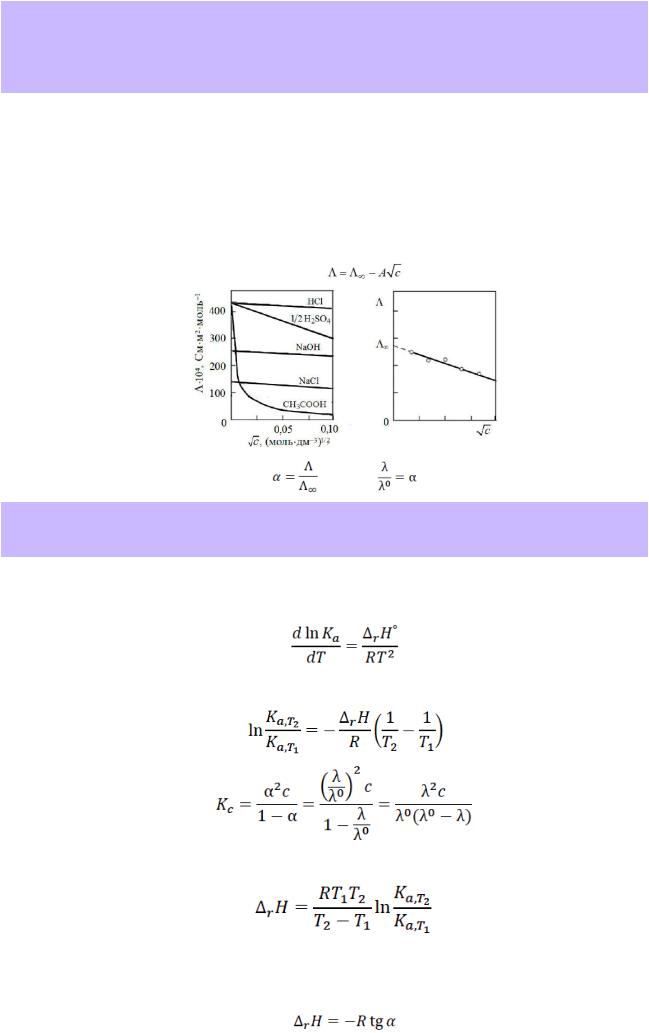
47.Молярная и эквивалентная электропроводности растворов электролитов, их зависимость от концентрации (при T=const) для сильных и слабых электролитов. Предельная электропроводность раствора электролита, уравнение квадратного корня Кольрауша. Расчет степени диссоциации слабого электролита по данным об электропроводности раствора.
(см. вопрос 41)
Зависимость молярной электрической проводимости сильного и слабого электролита от концентрации
Кольрауш установил, что в области невысоких концентраций молярная электрическая проводимость растворов сильных электролитов практически линейно зависит от квадратного корня из концентрации и описывается уравнением (закон квадратного корня Кольрауша):
48.Как на основании экспериментальных данных об электрической проводимости раствора слабого электролита рассчитать эффективную теплоту его диссоциации? Укажите основные этапы этого расчета, приведите соответствующие расчетные формулы.
Зависимость теплоты диссоциации (DHop) от температуры при p=const передается уравнением изобары Вант-Гоффа:
Для небольшого температурного интервала DHop = const, тогда:
Находим KD и подставляем в уравнение:
Если известны значения константы диссоциации при нескольких температурах, то величину DHop определяют построением графика lnK = f(1/T). Данная зависимость имеет линейный характер. DHop находят по тангенсу угла наклона прямой к оси абсцисс:

49.Имеются данные о зависимости электропроводности раствора от концентрации электролита. Какие графические зависимости необходимо построить, чтобы получить ответ на вопрос – является данный электролит сильным или слабым? Какие характеристики растворов электролитов при этом могут быть определены?
Для сильных — уравнение квадратного корня Кольрауша. Для слабых — Краус Брей. (см. вопросы 43 и 53)
50.Приведите аналитические выражения двух законов Кольрауша: уравнения квадратного корня и закона независимого движения ионов. Для каких электролитов (слабых и/или сильных) и при каких условиях справедливы эти выражения?
Закон квадратного корня Кольрауша:
В области невысоких концентраций молярная электрическая проводимость растворов сильных электролитов практически линейно зависит от квадратного корня из концентрации и описывается уравнением:
Закон независимости движения ионов Кольрауша:
В бесконечно разбавленном растворе силы взаимодействия между ионами растворённого вещества пренебрежимо малы, при наложении внешнего электрического поля ионы двигаются независимо друг от друга. Предельная эквивалентная электропроводность раствора электролита при бесконечном разведении l0 равна сумме предельных эквивалентных ионных электропроводностей катиона l0+ и аниона l0-, которые зависят от природы ионов, растворителя и от температуры, но не зависят от того, растворение какого электролита вызвало появление в растворе ионов данного вида.
51.Предельная электрическая проводимость растворов электролитов при бесконечном разведении. Закон независимости движения ионов. Расположите перечисленные системы в порядке возрастания эквивалентной электрической проводимости водных растворов при бесконечном разведении и температуре 25оС: (дан ряд водных растворов электролитов). Приведите обоснование ответа.
(см. вопрос 50)
52.Методы определения эквивалентной электрической проводимости растворов слабых и сильных электролитов при бесконечном разведении.
Для сильных электролитов можно построить график в координатах λ = f(ÖC). График будет являться прямой линией. Экстраполировав его на вертикальную ось, получим значение λ0.
Для слабых электролитов:
-по закону независимости движения ионов Кольрауша  с использованием справочных данных
с использованием справочных данных
-по данным о предельных эквивалентных электрических проводимостей сильных электролитов (сложение/вычитание диссоциаций)
-построить график 1/l = f(lc) и продлить его до пересечения с осью ординат (метод Крауса Брея)
53.Расчёт степени диссоциации и константы диссоциации слабого электролита по данным об электрической проводимости растворов. Метод Крауса–Брея.

В первом приближении степень диссоциации a можно вычислить из соотношения a=l/l0. Подставив это значение в уравнение закона разведения Оствальда получим:
Таким образом, для вычисления константы диссоциации экспериментально определяют молярную электрическую проводимость l, а значение l0 получают из суммы предельных подвижностей ионов. В случае отсутствия такие данных можно использовать графический метод Крауса-Брея. Уравнение выше можно преобразовать к виду:
Это уравнение прямой в координатах 1/l – lс с тангенсом угла наклона, равным 1/l20Kd,
а отрезок, отсекаемый прямой на оси ординат, равен 1/l0.
54.Скорость движения и подвижность иона. Влияние природы иона и природы растворителя на подвижность иона во внешнем электрическом поле. Уравнение Стокса. Связь предельной эквивалентной электрической проводимости иона с его подвижностью.
(см. вопрос 46)
Больше заряд — больше подвижность, больше вязкость — меньше подвижность.
55.Зависимость скорости движения и подвижности иона от его заряда и размеров (радиуса). Кристаллографический радиус иона Li+ меньше, чем иона K+. Какой из ионов дает больший вклад в электропроводность водных растворов хлоридов солей этих металлов при бесконечном разведении при одной и той же температуре? Для обоснования ответа приведите уравнения, связывающие между собой названные величины. (возможно указание и других ионов)
56.Числа переноса и подвижности ионов в растворе электролита, их связь с электрической проводимостью ионов. Сравните предельные числа переноса катиона и аниона в водном растворе … (дан конкретный бинарный электролит). Эстафетный механизм переноса электрического тока ионами гидроксония и гидроксила.
Число переноса ионов (t) – доля тока (общего потока электрических зарядов j), переносимая ионами данного вида. Для раствора сильного электролита, содержащего один вид катионов и один вид анионов:
Числа переноса и подвижности катионов и анионов различаются вследствие несовпадения стоксовских радиусов ионов. Сумма чисел переноса всех видов ионов в растворе электролита равна 1:
Эстафетный механизм:

Электрические подвижности и молярные электрические проводимости ионов H+ и OH- аномально велики. Для объяснения высоких значений электрических подвижностей и электрических проводимостей ионов H3O+ и OH- Гротгусом был предложен так называемый эстафетный механизм переноса электричества. Сущность предложенного Гротгусом механизма поясняет приведенная схема:
Электричество переносится, главным образом, не ионами гидроксония в ходе их перемещения к катоду, а протонами, передающимися от одной молекулы воды к другой как эстафетная палочка.
Аналогичным образом можно объяснить бόльшую подвижность гидроксид-ионов. В этом случае протоны переходят от молекул воды к ионам OH-, что приводит к видимому перемещению ионов по направлению к положительному электроду.
57.Как по данным об электрической проводимости растворов сильных электролитов определить эквивалентную электрическую проводимость при бесконечном разведении для раствора слабого электролита в том же растворителе? Какой закон лежит в основе метода определения? Проиллюстрируйте процедуру расчета каким-либо произвольным примером.
58.Толкование эффектов ион-ионного взаимодействия (торможения) в растворе в терминах ионной атмосферы. Опыты (эффекты) Вина и Дебая–Фалькенхагена.
Электрофоретический эффект торможения(DLэ)
Под действием электрического поля центральный ион начинает перемещаться к одному из электродов, а ионная атмосфера – в противоположном направлении, так как все ионы гидратированы, то при своём движении они одновременно переносят растворитель: ион перемещается как бы во встречном потоке растворителя, это создаёт дополнительную силу трения, что приводит к снижению его подвижности и, как следствие, к
снижению электрической проводимости.
Релаксационный эффект торможения (DLр)
Поскольку ион и его ионная атмосфера при наложении внешнего электрического поля движутся в разных направлениях, то центральный ион смещается от центра ионной атмосферы, в результате чего нарушается ее симметрия относительно центрального иона. Во время движения иона новая ионная

атмосфера не успевает сформироваться, а старая – полностью разрушиться. Позади движущегося иона возникает некоторый избыток зарядов противоположного знака, сферическая симметрия ионной атмосферы нарушается. Между ионом и остатками ионной атмосферы возникает противоположно направленное электрическое поле Ei, которое тормозит движение иона.
Эффект Вина:
При высокой напряжённости электрического поля ионы движутся настолько быстро, что ионная атмосфера не успевает образовываться и её тормозящее действие исчезает, т.е. ни электрофоретический, ни релаксационный эффекты торможения не проявляются (DLэ=0, DLр=0), а электропроводность раствора электролита приближается к предельному значению L=L¥).
Эффект Дебая–Фалькенхагена:
При наложении переменного электрического поля высокой частоты ион практически не имеет возможности скольконибудь значительно сместиться от своего исходного положения, совершая лишь небольшие колебания с очень малой амплитудой внутри ионной атмосферы, в результате ионная атмосфера не успевает в заметной степени разрушиться и сохраняет свою симметрию. (DLр=0).
59.Зависимость предельной электропроводности растворов электролитов от температуры. Правило Вальдена–Писсаржевского, особенности его применения, обоснование соответствующего выражения в терминах теории Стокса.
Температурную зависимость предельной электропроводимости растворов на практике описывают приближенными уравнениями — линейный и квадратичным:
Правило Вальдена–Писсаржевского:
Произведение эквивалентной электропроводности раствора при бесконечном разведении на вязкость растворителя есть величина постоянная: 
Данное эмпирическое правило лучше всего выполняется при постоянстве стоксовского радиуса иона – для крупных органических ионов, которые практически не сольватированы.
ЭДС ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
60.Возникновение скачка потенциала на границе раздела проводников I и II рода. Обратимые электроды и обратимые гальванические элементы. Классификация гальванических элементов. Условная запись правильно разомкнутого гальванического элемента. Электродвижущая сила (ЭДС) гальванического элемента.
В настоящее время существует несколько теорий, объясняющих возникновение скачка потенциала на границе раствор – металл. Наиболее современной является сольватационная теория электродного потенциала. В соответствии с этой теорией скачок потенциала на границе раствор – металл вызван следующими процессами:
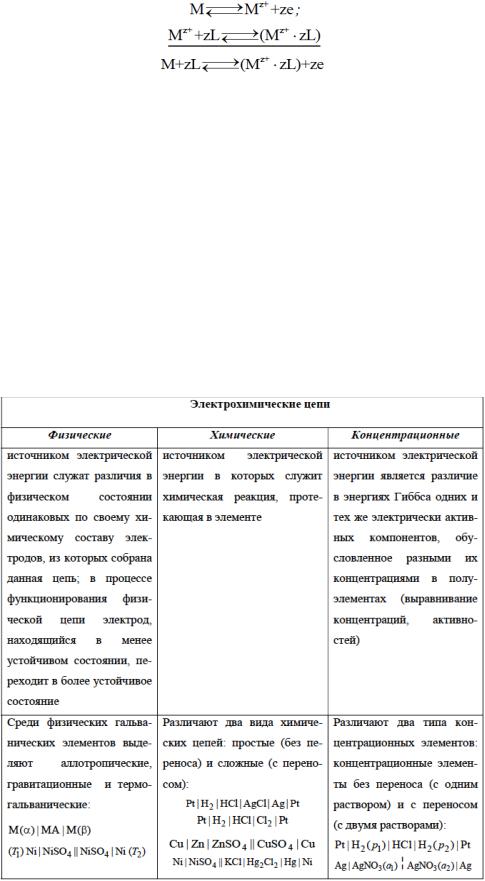
1.ионизацией атомов металлов на ионы и электроны внутри металла. Согласно современным представлениям о строении металлов в узлах кристаллической решетки расположены ионы металла, находящиеся в равновесии с электронами, которые образуют электронный газ, обеспечивающий электрическую проводимость металлов;
2.сольватацией ионов металла, находящихся на его поверхности, при соприкосновении с раствором, содержащим молекулы растворителя L.
Обе стадии и общую реакцию на границе раствор/металл можно записать в виде реакций:
Обратимые электроды — электроды, на которых при изменении направления электрического поля (тока) на противоположное протекает та же самая по химической природе электродная полуреакция, но в обратном направлении.
Пример обратимого электрода: цинк, погруженный в раствор соли цинка. Если поместить цинк в разбавленную серную кислоту, то анодный процесс с таким электродом – это окисление цинка, а катодный процесс с таким электродом – восстановление водорода, т. е. при перемене направления тока происходит не смена направления процесса, а начинает протекать совершенно иной процесс. В таком сочетании «металл – раствор» цинковый электрод является необратимым, и любая электрохимическая цепь с ним тоже будет необратимой.
Обратимые гальванические элементы — электрохимические системы, выполняющие функции гальванического элемента и электролизера одновременно. Состоят из обратимых электродов.
Пример: электрод Даниэля-Якоби Классификация ГЭ:

Правильно разомкнутым называется гальванический элемент, электрические контакты которого (точки присоединения внешней цепи) изготовлены из одного и того же металла. Пример: M2|M1|L1 ¦ L2|M2
ЭДС гальванического элемента - разность электродных потенциалов составляющих его электродов. E = Eпр — Eлев > 0.
ЭДС гальванического элемента есть разность электрических потенциалов между идентичными металлическими контактами его электродов при нулевом токе через элемент
61.Принципиальная схема, иллюстрирующая возникновение ЭДС гальванического элемента. Поверхностный потенциал фазы и внутренний потенциал фазы. Вольтапотенциал и Гальвани-потенциал. Диффузионный скачок потенциала, причина его возникновения, способ его существенного уменьшения, применяемый на практике.
Принципиальная схема: элемент Даниэля-Якоби:
Поверхностный потенциал отвечает работе переноса элементарного положительного заряда из глубины фазы в точку в вакууме, расположенную в непосредственной близости от ее поверхности (обычно принимается 10-8–10-6 м).
Внешний потенциал y фазы a отвечает работе переноса элементарного нематериального заряда из бесконечности в точку в вакууме (воздухе), расположенную на расстоянии 10-8–10-6 м от поверхности данной фазы. Возникновение внешнего потенциала обусловлено наличием у фазы электрического заряда. Если фаза не несет заряда, то электрическое поле вокруг нее отсутствует, а внешний потенциал равен нулю.
Внутренний потенциал фазы — работа (в расчете на моль) по перемещению элементарного положительного электрического заряда из бесконечности в вакууме внутрь данной фазы. Внутренний потенциал можно представить как сумму двух величин
– поверхностного потенциала и внешнего потенциала:
Разница внешних потенциалов двух фаз (например, металла и раствора электролита) называется вольта-потенциалом:
Разница внутренних потенциалов контактирующих фаз, называется гальванипотенциалом:
В отличие от гальвани-потенциала, вольта-потенциал поддается экспериментальному определению, поскольку точки, между которыми проводится измерение, находятся в одной фазе (воздухе).
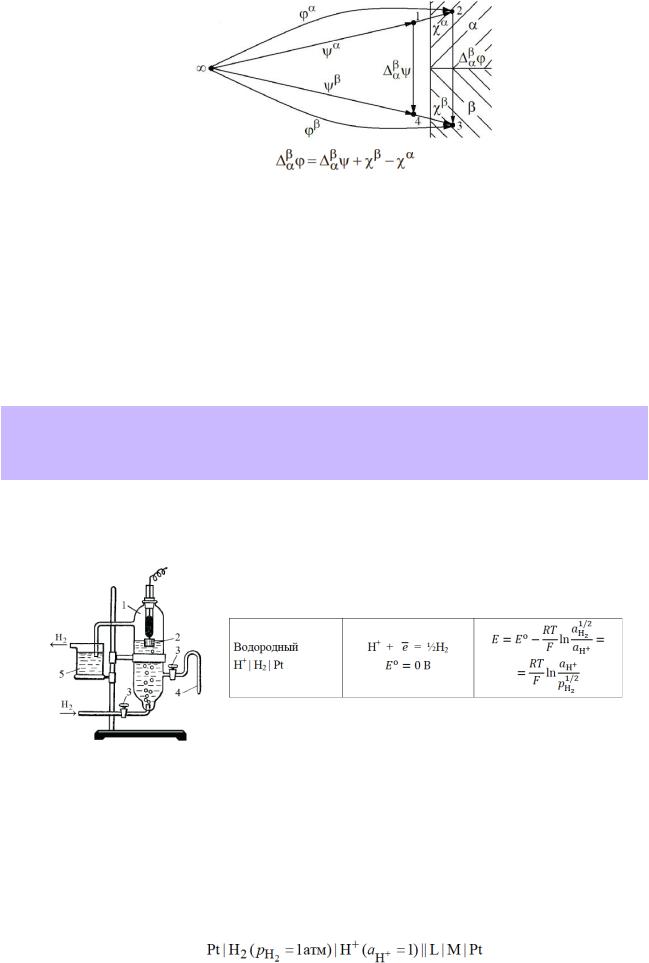
Связь между рассмотренными выше скачками потенциала на границе раздела двух фаз можно проиллюстрировать с помощью схемы:
Скачок потенциала на поверхности раздела двух контактирующих растворов, различающихся химической природой или концентрацией электролита в одном и том же растворителе, называют диффузионным потенциалом.
Причиной возникновения диффузионного потенциала служит различие в скоростях движения (диффузии) ионов через границу раздела жидких фаз (растворов электролитов).
Для уменьшения диффузионного потенциала растворы электролитов в электрохимических системах соединяют с помощью солевого мостика, наполненного насыщенным раствором такого электролита, у которого подвижности и скорости диффузии катиона и аниона близки. KCl, NH4Cl, KNO3, NH4NO3, неводные растворы: KCSN в С2H5OH или NaI в CH3OH.
62.Водородный электрод. Условный электродный потенциал по водородной шкале (определение). Связь ЭДС гальванического элемента с условными электродными потенциалами. Термины «катод» и «анод» в применении к электродам гальванического элемента (определения).
Водородный электрод представляет собой платиновую пластинку, частично погруженную в раствор, содержащий ионы водорода (раствор кислоты). Через раствор пропускается газообразный водород.
1 – сосуд с раствором электролита, 2 – платиновая пластинка с электросажденной платиновой чернью (Pt/Pt-электрод), 3 – краны, 4 – сифон, 5 – гидравлический затвор.
Стандартный водородный электрод – водородный электрод с активностью ионов водорода (гидроксония) в растворе aH+=1 и давлением водорода pH2=1 атм. Электродный потенциал стандартного водородного электрода принимается равным нулю при всех температурах.
Под относительным электродным потенциалом или просто электродным потенциалом понимают ЭДС электрохимической цепи, составленной из данного электрода (в схеме справа) и стандартного водородного электрода (в схеме слева), т.е. ЭДС элемента:

Условным потенциалом электрода по водородной шкале (электродным потенциалом E, B) называется разность электрических потенциалов между металлическими контактами (Pt) данного электрода и водородного электрода в стандартных условиях в растворе кислоты, образующих реальный или гипотетический правильно разомкнутый гальванический элемент без переноса.
ЭДС гальванического элемента может быть рассчитана как разность электродных потенциалов правого (более положительного) и левого (более отрицательного) электродов.
Положительный электрод гальванического элемента, к которому перемещаются положительно заряженные ионы – катионы и на котором происходит их электрохимическое восстановление, называют катодом, отрицательный электрод, к которому перемещаются анионы и на котором протекает процесс их электрохимического окисления, – анодом.
63.Классификация электродов, примеры электродов с уравнениями электродных полуреакций. Стандартные электродные потенциалы по водородной шкале. Уравнение Нернста для электродного потенциала (общий вид и конкретное выражение на примере одного из электродов).
Электроды первого рода – электрохимическая система, состоящая из электронного проводника (металла или металлоида), погруженного в раствор, содержащий его ионы. В электродах первого рода восстановленной формой является металл электрода, а окисленной формой - ионы этого металла (простые или комплексные). К электродам первого рода относят амальгамные электроды, в которых восстановленной формой
является амальгама - сплав металла с ртутью.
Электрод 2-го рода – металлическая пластинка, покрытая слоем малорастворимого соединения этого металла и помещенная в раствор электролита, содержащего те же анионы, что и малорастворимое соединение. Потенциал электрода второго рода зависит только от активности аниона в растворе электролита. Электрод обратим по аниону.
Газовые электроды состоят из металлического проводника, который контактирует одновременно и с электрохимически активным газом, пропускаемым через раствор электролита, и с самим раствором, содержащим ионы, природа которых соответствует продуктам окисления или восстановления этого газа на электроде. Газовые электроды могут быть обратимы относительно катиона (водородный электрод) или относительно аниона (хлорный и кислородный электроды). В качестве проводника с электронной проводимостью используют инертные металлы: платина, иридий, золото и т.п.
Окислительно-восстановительный электрод - инертный проводящий материал (токоподвод) (Pt, Ti, C), погруженный в раствор, содержащий окисленную и восстановленную форму одного и того же элемента. Окислительно-восстановительные электроды можно разделить на простые и сложные. Для простых окислительновосстановительных электродов электродная реакция сводится к изменению степени окисления без изменения состава реагирующих веществ. В сложных окислительновосстановительных электродах реакция протекает с изменением степени окисления и состава реагирующих веществ. В таких реакциях обычно участвуют ионы Н3О+, OН- и молекулы воды.
Примеры смотреть в таблице ниже.
