
Учебное пособие 2150
.pdf
образованием малорастворимых соединений и заменой одних ионов в растворе другими с большим или меньшим значением молярной электропроводности, содержащимися в растворе титранта. Например, при титровании раствора нитрата серебра гидроксидом натрия:










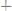




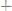

















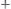




 ,
,
электропроводность раствора до точки эквивалентности падает за счет образования осадка 



 и замены ионов
и замены ионов
менее подвижными
ионами 


 . В избытке титранта электропроводность возрастает с увеличением концентрации NaOH (рис. 29, г). Однако, если нитрат серебра титровать гидроксидом калия, то кривая титрования будет иметь вид, представленный на рис. 29, д, поскольку ионы
. В избытке титранта электропроводность возрастает с увеличением концентрации NaOH (рис. 29, г). Однако, если нитрат серебра титровать гидроксидом калия, то кривая титрования будет иметь вид, представленный на рис. 29, д, поскольку ионы 

 заменяются в ходе реакции осаждения гидроксида серебра более подвижными ионами:
заменяются в ходе реакции осаждения гидроксида серебра более подвижными ионами:







































 .
.
Кондуктометрическое титрование является удобным методом анализа окрашенных и мутных растворов, а также растворов, содержащих вещества, реагирующие с индикаторами, используемыми при химическом объемном анализе. Метод может быть применен в установках автоматического титрования. Однако необходимо учитывать, что этот метод не является универсальным. С его помощью можно получить результаты с точностью 1-2 % только для тех реакций, в которых участвуют ионы, характеризующиеся значениями предельной электропроводности, которые обеспечивают согласно уравнению существенную разницу между значениями 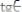

 и
и 

 .
.
Достоинства метода: возможность раздельного определения смесей кислот и оснований, титрование мутных и окрашенных растворов при точности 2 %; высокая чувствительность (нижняя граница определяемых концентраций ~10-4-10-5 М), достаточно высокая точность
171
(относительная погрешность определения 0,1-2 %); простота методик, доступность аппаратуры, а также автоматизации анализа. Методы кондуктометрии бывают постояннотоковые и переменнотоковые последние могут быть низкочастотными (частота тока <105 Гц) или высокочастотными (>105 Гц). Различают контактную и бесконтактную кондуктометрию в зависимости от наличия или отсутствия контакта между электролитом и входными цепями измерительного прибора наиболее распространены контактный низкочастотный и бесконтактный высокочастотный методы.
Контактные методы. Измерения проводят с помощью контактных ячеек (рис. 30, а). При этом используют электроды из Pt, Ti, нержавеющей стали. Для измерения х растворов с высокой концентрацией электролита (10-2-10-3 М) применяют платинированные электроды с развитой поверхностью.
В прямой кондуктометрии непосредственно определяют концентрацию электролита по æ раствора (если между этими величинами имеется линейная зависимость). Метод применяется главным образом для анализа разбавленных растворов. В случае концентрированных растворов необходимо строить градуировочные графики.
На методе прямой кондуктометрии основаны конструкции солемеров и других кондуктометрических устройств, позволяющих определять различные соли в минеральной, речной и морской водах, физиологических жидкостях. Прямую кондуктометрию применяют при контроле регенерации ионитов, очистки воды, промывки осадков, при оценке качества вин, соков, напитков, чистоты органических растворителей, газов, твердых солей, текстильных материалов, бумаги, зерна, почвы. По электропроводности поглотителей определяют количества газов (в частности, CO2, NO2, SO2), следовательно, содержание соответствующих элементов, например: С, N, S, в металлах, сплавах и органических соединениях.
172
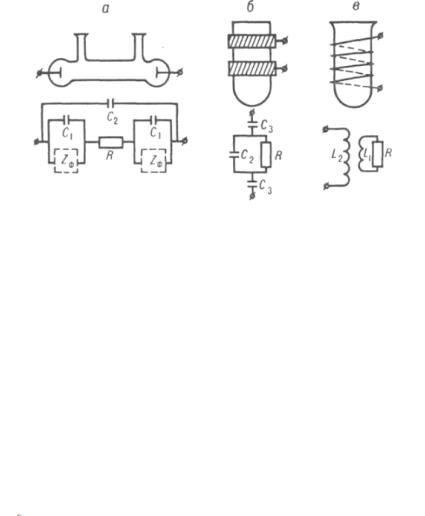
Рис. 30. Кондуктометрические ячейки и их эквивалентные электрические схемы: a – контактная ячейка; б – емкостная ячейка; в – индуктивная ячейка; R – сопротивление электролита; С1 – емкость двойного электрич. слоя на межфазной границе электрод – электролит; С2 – емкость р-ра; С3 – емкость конденсатора, образованного р-ром, стенкой ячейки и внешним электродом; Zф – фарадеевский импеданс, связанный с протекающей на границе электрод – электролит электрохимической реакцией; L1 и L2 – индуктивности электролита и катушки
В косвенной кондуктометрии, позволяющей исследовать смеси электролитов, наряду с электропроводностью растворов измеряют рефракцию, вязкость, рН, плотность или другие величины. Например, при анализе пром. нитрующих смесей, содержащих H2SO4, HNO3 и 



 , дополнительно измеряют плотность. По совокупности
, дополнительно измеряют плотность. По совокупности
всех экспериментальных данных определяют количеств, состав смеси. Кондуктометрическое титрование основано на изменении раствора при химических реакциях, связанном с изменением концентрации ионов различной подвижности. Кондуктометрическое титрование проводят в водных, водноорганических и неводных средах. Кривые титрования,
173
представляющие собой зависимость æ от количества прибавленного реагента (титранта), имеют излом в точке эквивалентности. При титровании смесей электролитов число изломов равно числу определяемых компонентов, взаимодействующих с титрантом. Форма кривых может быть разной (рис. 31). Кондуктометрическое титрование может быть основано на различных реакциях наиболее широко используются кислотно-основные взаимодействия. Так, разработаны методы определения в воде кислот и оснований с рК = 10, солей слабых кислот или оснований.
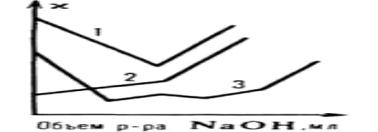
Рис. 31. Кривые кондуктометрического титрования
в контактной ячейке раствором NaOH: 1 – соляной кислоты;
2– CH3COOH; 3 – смеси HCl + CH3COOH + (C2H5)3N• HCl
+фенол
При титровании сильными основаниями сильных или слабых кислот æ до точки эквивалентности соответственно
понижается (высокоподвижные ионы Н+ заменяются менее подвижными катионами титранта) или увеличивается (в результате диссоциации соли). При избытке сильного основания после точки эквивалентности (резко увеличивается æ) (рис. 31, кр. 1 и 2). При титровании солей (до точки эквивалентности æ сравнительно мало изменяется, подвижности заменяющих друг друга ионов близки. Поэтому возможен анализ смесей солей с кислотами или основаниями, содержащих от 2 до 5 компонентов (рис. 31, кр. 3).
174
При хронокондуктометрическом титровании раствор титранта подается в реакционный сосуд (электрохим. ячейку) с постоянной скоростью, так что время титрования пропорционально количеству прибавленного титранта. Концентрации веществ определяют по кривым «электропроводность раствора – время титрования». Обычно осуществляется автоматическая запись кривых. Контактные методы отличаются высокой точностью. Они применяются не только для химического анализа, но и для изучения кинетики реакций, определения констант диссоциации (ассоциации) электролитов, растворимости осадков, коэффициента диффузии.
Бесконтактные методы. Применяются для отно-
сительных измерений электропроводности, главным образом для высокочастотного титрования. Измерения проводят с применением емкостных (С-) или индуктивных (L-) ячеек, представляющих собой сосуды из диэлектрика, которые соответственно имеют с внешней стороны не менее двух металлических электродов (рис. 30, б) или помещены в магнитное поле катушки индуктивности (рис. 30, в). Электроды С-ячейки или катушка индуктивности соединяются с высокочастотным генератором. Электропроводность электролита при токе высокой частоты обусловлена не только реальным перемещением зарядов, но в большей мере потерями электрической энергии в емкостной и индуктивных ячейках. Это отражается на реактивной
составляющей X полного сопротивления (импеданса) цепи: Z2 = R2 + X2,
где R-активное сопротивление, X=XL-ХC, XL и ХC – соотв. индуктивное и емкостное сопротивление цепи. Индуктивные ячейки используют обычно для измерения сравнительно высокой электропроводности, а емкостные – для измерения низкой электропроводности. Чувствительность измерения повышается в С-ячейках при использовании диэлектриков с высокой диэлектрич. проницаемостью, уменьшении толщины
175
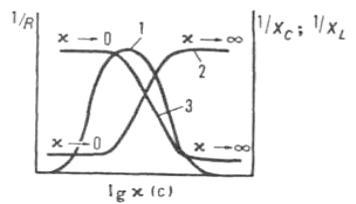
стенок сосуда и увеличении площади электродов, а в L- ячейках – с увеличением объема пробы. Применяются также комбинированные LC-ячейки, RC- и RL-ячейки с повышенной чувствительностью, а также многозвенные ячейки с различным числом электродов, включенных в фазовращающие контуры автоколебательных генераторов. При высокочастотном титровании необходимо предварительно выбирать условия с учетом характеристич. кривой ячейки, тзависимости 1/XL или 1/ХC от х (рис. 32). Чем больше интервал между значениями 0 и ∞, в котором эта зависимость линейна, тем удобнее ячейка для измерений. Кроме того, чувствительность измерений различна на различных участках характеристической кривой; например, в случае кр. 1, рис.38 чувствительность наименьшая в максимуме и наибольшая в точках перегиба. Кривые высокочастотного титрования имеют минимум (кр. 1 на рис. 32) или максимум, а также могут представлять собой М- образные кривые.
Рис. 32. Характеристические кривые бесконтактных высокочастотных ячеек: 1, 2, 3 – зависимости обратных величин соответсвующей активной, емкостной и индуктивной составляющих Z от lg
176
Бесконтактные методы уступают контактным методам по точности, но превосходят их по чувствительности. Кроме того, из-за отсутствия взаимодействия материала электрода с исследуемой средой эти методы позволяют проводить измерения при высоких и низких температурах, в агрессивных средах, в замкнутых объемах. Они применяются для кислотно-основных титрований на фоне дифференцирующих растворителей (CH3COOH, ацетон, диоксан), детектирования веществ в хроматографии, экспресс-анализа органических соединений, воздуха и промышленных газов, анализа химических реактивов, контроля качества лекарственных средств в запаянных ампулах, для изучения комплексообразования, гидролиза, сольватации, фазовых переходов.
Лекция № 16 Вольтамперометрия. Амперометрическое титрование
Вольтамперометрический метод анализа основан на использовании явления поляризации микроэлектрода, получении и интерпретации вольтамперных (поляризационных) кривых, отражающих зависимость силы тока от приложенного напряжения. Вольтамперометрия использует два электрода: рабочий поляризуемый электрод с малой поверхностью и неполяризуемый электрод сравнения. Если рабочим электродом является ртутный капельный электрод, то метод анализа называется полярографическим.
Основные преимущества метода 1. Экспрессность (3-5 мин.). Применение современной
электронной аппаратуры позволяет использовать этот метод для автоматического контроля производственных процессов.
2.Малый предел обнаружения: 10–5 - 10–6 моль/дм3 (в некоторых случаях до 10–9 моль/дм3).
3.Достаточная точность ≈ 3 %.
177

4.Объективность эксперимента, так как о результатах судят по показанию приборов.
5.Возможность одновременного определения нескольких
компонентов без их предварительного разделения. 6. Возможность автоматизации.
Теоретические основы вольтамперометрии
При исследовании зависимости силы тока (Ам) от напряжения (В) используют электроды, резко отличающиеся размерами их поверхности. Поверхность одного из них (микроэлектрод) во много раз меньше поверхности другого. Второй электрод – слой ртути на дне электролизёра или насыщенный каломельный электрод. Постепенное повышение напряжения, а, следовательно, и силы тока, приводит к такому моменту, когда количество восстанавливающихся ионов будет равно количеству ионов, поступающих к микроэлектроду за счёт диффузии. Такую силу тока называют предельным или диффузионным током (Iд; I пред).
Уравнение Ильковича устанавливает взаимосвязь Iд с концентрацией определяемого иона:
где n – заряд иона; D – коэффициент диффузии, см2•с–1; m – масса ртути, вытекающей из капилляра в 1 с, г•с–1; τ – время образования капли (период капания), с; с – молярная концентрация, моль/дм3.
Коэффициент диффузии определяется с помощью стандартных растворов, при m, τ = const, а, следовательно, и D = const. Тогда уравнение Ильковича примет вид:
Качественной характеристикой полярографически активного вещества является величина Е1/2. Для его определения снимают вольтамперную кривую исследуемого вещества на фоне определяемого электролита в интервале Е от 0 до -2,0В. Потенциал полуволны Е1/2 характеризует
178
природу восстанавливающего катиона и не зависит от его концентрации.
Вольтамперометрия, совокупность электрохимических методов исследования и анализа, основанных на изучении зависимости силы тока в электролитической ячейке от потенциала, погруженного в анализируемый раствор индикаторного микроэлектрода, на котором реагирует исследуемое электрохимически активное (электроактивное) вещество. В ячейку помещают помимо индикаторного вспомогательный электрод со значительно большей поверхностью, чтобы при прохождении тока его потенциал практически не менялся (неполяризующийся электрод). Разность потенциалов индикаторного и вспомогательного электродов Е описывается уравнением:
Е = U - I•R,
где U – поляризующее напряжение; R – сопротивление раствора.
В анализируемый раствор вводят в большой концентрации индифферентный электролит (фон), чтобы: вопервых, уменьшить величину R и, во-вторых, исключить миграционный ток, вызываемый действием электрического поля на электроактивные вещества (устаревшее – деполяризаторы). При низких концентрациях этих веществ омическое падение напряжения I•R в растворе очень мало. Для полной компенсации омического падения напряжения применяют потенциостатирование и трехэлектродные ячейки, содержащие дополнительно электрод сравнения. В этих условиях E

 U
U
В качестве индикаторных микроэлектродов используют стационарные и вращающиеся – из металла (ртуть, серебро, золото, платина), углеродных материалов (например, графит), а также капающие электроды (из ртути, амальгам, галлия). Последние представляют собой капилляры, из которых по каплям вытекает жидкий металл. Вольтамперометрия с использованием капающих электродов, потенциал которых



 )
)