
- •Лекция №43-44 нитросоединения
- •Нитроалканы
- •Методы синтеза
- •Физические свойства и строение
- •Ароматические нитросоединения
- •Методы получения
- •Физические свойства и строение
- •Химические свойства Восстановление нитрогруппы
- •При восстановлении в щелочной среде в избытке восстановителя конечным продуктом восстановления нитроарена является гидразоарен (диарилгидразин)
Лекция №43-44 нитросоединения
План.
Нитроалканы.
Ароматические нитросоединения.
Нитросоединения- производные углеводородов в которых один или несколько атомов водорода замещены нитрогруппой – NO2.
Нитроалканы
Нитроалканы - производные алканов, в которых один или несколько атомов водорода замещены нитрогруппой.
Общая формула мононитроалканов CnH2n+1NO2.
П ри
образовании названий нитроалканов
выбирается самая длинная углеводородная
цепь, нумерация которой начинается с
конца, к которому ближе расположена
нитрогруппа. Последняя указывается с
помощью приставки «нитро». Например:
ри
образовании названий нитроалканов
выбирается самая длинная углеводородная
цепь, нумерация которой начинается с
конца, к которому ближе расположена
нитрогруппа. Последняя указывается с
помощью приставки «нитро». Например:
2-нитробутан
Методы синтеза
1.Нитрование алканов
RH HNO3 RNO2
Из метана получают нитрометан, при нитровании гомологов метана образуется смесь нитроалканов:
CH3CH2CH3 HNO3;t;((((( CH3NO2 + CH3CH2NO2 + CH3CH(NO2)CH3 +
+ CH3CH2CH2NO2
2.Алкилирование нитритов
R-Br + AgNO2 R-NO2 + AgBr
R-Br + NaNO2 R-NO2 + NaBr
Поскольку нитрит-анионы имеют амбидентный характер, для получения высокого выхода нитроалкана используют апротонные неполярные растворители и умеренные температуры.
Физические свойства и строение
Нитроалканы являются бесцветными или желтоватыми жидкостями или кристаллическими веществами со слабым запахом.
Д ля
мононитроалканов характерны большие
дипольные моменты. Причиной значительной
полярности нитроалканов кроется в
электронном строении нитрогруппы,
содержащей семиполярную связь
ля
мононитроалканов характерны большие
дипольные моменты. Причиной значительной
полярности нитроалканов кроется в
электронном строении нитрогруппы,
содержащей семиполярную связь
Выравнивание связей N-O подтверждается рентгеноструктурным анализом: связь N-O в нитрогруппе короче связи N-O в гидроксиламине, но длинее связи в нитрозогруппе –N=O.
Высокая электроотрицательность атомов N и О, кратность связи N=O и ее семиполярный характер обусловливают значительные электроноакцепторные свойства нитрогруппы (-I и –М-эффекты).
Для нитроалканов характерно слабое поглощение в УФ-области 270-280 нм. Это связано с электронными переходами типа неподеленной электронной пары атома кислорода на НСМО.
В ИК-спектрах наблюдаются максимумы поглощения связанные с симметричными и антисимметричными колебаниями связей N=O в областях 1370 см-1 и 1550 см-1.
Химические свойства нитроалканов.
Кислотность и таутомерные превращения нитроалканов.
Первичные и вторичные нитроалканы являются СН- кислотами.

Кислотность обусловлена стабилизацией образующегося карбаниона за счет электроноакцепторных свойств нитрогруппы.

Кислотность мононитроалканов в водных растворах сравнима с кислотностью фенолов. Если у одного атома углерода находится две или три нитрогруппы, кислотность резко возрастает.
 Анион
нитроалакана является амбидентным
подобно енолят-аниону. Например, при
его протонировании может образовываться,
кроме нитроалкана, другая таутомерная
форма.
Анион
нитроалакана является амбидентным
подобно енолят-аниону. Например, при
его протонировании может образовываться,
кроме нитроалкана, другая таутомерная
форма.
Таутомерную форму нитроалкана называю ациформой или нитроновой кислотой, которая в чистом виде не получена. Нитроновая кислота является ОН- кислотой средней силы (рКа=3,2).
Таким образом, нитросоединения следует рассматривать как таутомеры, реагирующие в нитро- и аци-формах.
В обычных условиях концентрация аци-формы ничтожна (10-5-10-7%). Равновесие смещается в правую сторону в щелочной среде вследствие образования солей.

Кристаллические соли щелочных и щелочно-земельных металлов устойчивы и хорошо растворимы в воде. Их иногда называют солями нитроновой кислоты. При подкислении растворов сначала образуется сама нитроновая кислота (ациформа), которая затем изомеризуется в нитроалкан.
Нитросоединения относятся к псевдокислотам, для которых характерно, что сами они нейтральны, не обладают электропроводностью, но тем не менее образуют нейтральные соли щелочных и щелочно-земельных металлов.
«Нейтрализация» нитросоединений основаниями происходит медленно, а истинных кислот - мгновенно.
Из других реакций нитроалканов отметим следующие.
Гидролиз в кислой среде с разрывом связей C-N.
CH3NO2 + H2O H2SO4 конц;((((((((( HCOOH + NH2OH + H2SO4
Эта реакция используется в технике для синтеза гидроксиламина и его сульфата.
 Замещение
Н-атомов при С на
галогены, остатки азотистой кислоты,
альдегидов, кетонов и т.д.
Замещение
Н-атомов при С на
галогены, остатки азотистой кислоты,
альдегидов, кетонов и т.д.
Реакция с HNO2 является качественной на нитроалканы. Третичные нитроалканы не реагируют, вторичные R2CH-NO2 образуют нитрозонитроалканы
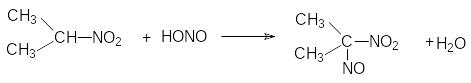
Первичные образуют с HNO2 нитрооксимы (нитроловые кислоты)

Эти бесцветные соединения образуют со щелочами соли нитроловых кислот кроваво-красного цвета.

