
Отчёт по лабораторной работе Поликонденсация
.pdf
Министерство образования и науки РФ МИРЭА - РОССИЙСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
Институт тонких химических технологий им. М.В.Ломоносова Кафедра физики и химии материалов имени Догадкина Б.А.
Отчёт по лабораторной работе “Поликонденсация фенола и формальдегида в щелочной среде”
Выполнила:
студентка группы ХЕБО-11-18 Ефремова О.Б.
Проверил: Емельянов С.В.
Москва 2020

Оглавление
Оглавление |
2 |
|
1. |
Введение |
3 |
2. |
Объекты и методы исследования |
6 |
3. |
Результаты и их обсуждение |
14 |
4. |
Выводы |
17 |
Список использованной литературы |
18 |
|
Приложение 1 |
19 |
|
2

1. Введение
Поликонденсация является важнейшим методом синтеза полимеров, широко используемым в технологии пластических масс.
Поликонденсация — процесс образования высокомолекулярных соединений, протекающий по механизму замещения и обычно сопровождающийся выделением низкомолекулярных побочных продуктов. Поэтому элементный состав полимера отличается от элементного состава исходных веществ.
В реакцию поликонденсации могут вступать исходные соединения (мономеры), содержащие две или более функциональные группы. При взаимодействии этих групп происходит отщепление молекулы низкомолекулярного соединения, с образованием новой группы, которая связывает остатки реагирующих молекул.
Поликонденсация представляет собой ступенчатый процесс. Рост цепи происходит в результате взаимодействия молекул мономера друг с другом, а также с промежуточными продуктами: олигомерными или полимерными молекулами или при взаимодействии олигомерных или полимерных молекул между собой. В поликонденсационной системе мономеры расходуются довольно быстро после начала реакции, однако увеличение молекулярной массы полимера происходит в течение всего процесса. Этим поликонденсация резко отличается от цепной полимеризации.
Реакция, в которой участвуют однородные молекулы называется гомополиконденсацией. Однако в большинстве случаев поликонденсация протекает с участием разнородных молекул. Такие реакции называют реакциями гетерополиконденсации.
Различают равновесную и неравновесную поликонденсацию. Для равновесной поликонденсации константа равновесия Kp≤1000, для неравновесной поликонденсации константы равновесия Kр>1000. Примером
3

равновесной поликонденсации является образование полиэфиров или полиамидов при нагревании дикарбоновых кислот с гликолями или диаминами. Примером неравновесной поликонденсации может служить реакция образования полиамидов или полиэфиров при поликонденсации хлорангидридов дикарбоновых кислот с диаминами или бисфенолами.
Необходимым условием, обеспечивающим достижение высокой молекулярной массы полимера в реакциях равновесной поликонденсации, является полное удаление низкомолекулярного побочного продукта. В этих случаях молекулярная масса полимера определяется равновесием между образующимися связями макромолекулы полимера, выделяющимся при поликонденсации низкомолекулярным продуктом и свободными функциональными группами мономера (или сомономеров). Поэтому смещение равновесия путем удаления низкомолекулярного продукта способствует получению полимера с большей молекулярной массой, как это видно из уравнения:
Pср=√(K/nB)
где Pср – средняя степень полимеризации; К — константа равновесия; nB — количество воды в системе, % (мол.).
Феноло-формальдегидные олигомеры (ФФО), которые до сих пор часто называют смолами, - олигомерные продукты конденсации фенола, а также его гомологов (крезолов, ксиленолов) или многоатомных фенолов (например, резорцина) с альдегидами (формальдегидом и фурфуролом).
Полиприсоединениеступенчатый процесс образования высокомолекулярного соединения, протекающий без выделения низкомолекулярного побочного продукта.
Отличие поликонденсации от полиприсоединения:
1)Особенность строения исходных мономеров: в полиприсоединении участвуют соединения с кратными связями, в поликонденсации
4

участвуют соединения с присутствием не менее 2-х функциональных групп.
2)Тип реакции: полиприсоединение - реакция присоединения, поликонденсацияреакция обмена.
3)Продукт реакции: при полиприсоединении выделяется только полимер и того же состава в звене, что и мономер, при поликонденсации выделяется полимер, отличающийся по составу в звене от исходных мономеров и побочное низкомолекулярное вещество.
4)Молекулярная масса полимера: полиприсоединение - порядка 104-106; поликонденсация - обычно не превышает 50 000. [3]
Цель данной работы: Получение фенол-формальдегидной смолы в щелочной среде.
5
2. Объекты и методы исследования
Оборудование: круглодонная колба с обратным холодильником и мешалкой, термометр, фарфоровая чашка, металлическая пластинка. (Рис. установки см. Приложение 1)
Реактивы:
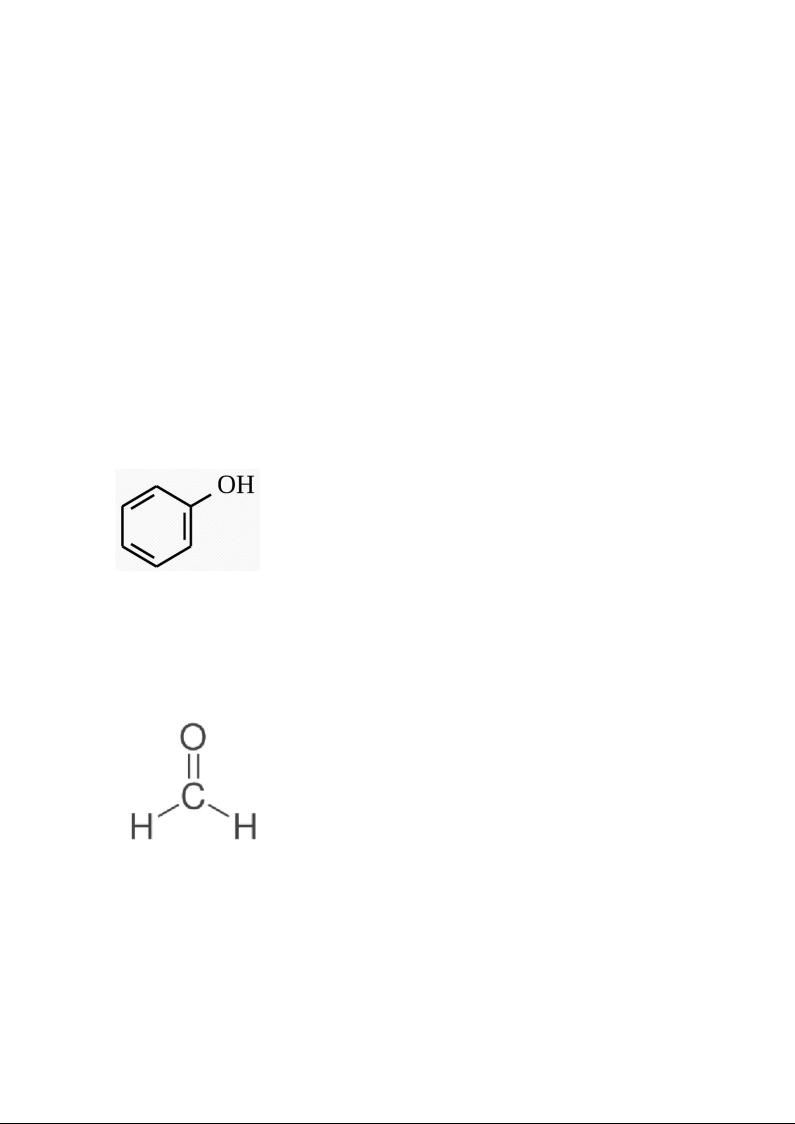
Фенол - С6H5ОН - 6,25 г. Мол. масса 94,12. Кристаллическое вещество.
Температура плавления 41°С. Токсичен, особенно его пары. Используется в качестве фенольного сырья. В данном соединении присутствуют 3 связи C-H (в пара- и двух орто-положениях), участвующие в замещении.
Формальдегид – |
СH2О - |
(в виде 40% раствора |
формалина) - 14,5 мл. |
|
|
|
|
Молекулярная масса 30. |
Бесцветная жидкость, |
3 |
|
плотность 0,926 г/см . |
|||
Токсичен, сильный лакриматор. В данном соединении присутствует связь С=О, способная к присоединению по атомам С и О.
Гидроксид натрия – NaOH – 0,2 г – Катализатор. Белое кристаллическое вещество, гигроскопичное, токсичное.
6

Объект исследования: Фенолформальдегидная смола:
При поликонденсации формальдегида с трифункциональными фенолами могут получаться как термопластичные, так и термореактивные олигомеры. Термопластичные (новолачные) олигомеры образуются в следующих случаях:
а) при избытке фенола (соотношение фенол : формальдегид 1:0,78—0,86) в присутствии кислотных катализаторов; при отсутствии избытка фенола образуются резольные олигомеры;
б) при большом избытке формальдегида (соотношение фенол: формальдегид 1 : 2—2,5) в присутствии сильных кислот в качестве катализатора; получаемые в этом случае олигомеры не отверждаются при нагревании, но при добавлении к ним небольшого количества оснований переходят в неплавкое и нерастворимое состояние.
Термореактивные (резольные) олигомеры образуются в следующих случаях:
а) при поликонденсации избытка трифункционального фенола с формальдегидом в присутствии основных катализаторов (в щелочной среде термореактивные олигомеры получаются даже при очень большом избытке фенола, который в этом случае остается растворенным в продукте реакции);
б) при небольшом избытке формальдегида в присутствии как основных, так и кислотных катализаторов.
Особенностью взаимодействия фенолов с формальдегидом является использование формальдегида главным образом в виде водных растворов.
7

Такой раствор имеет сложный состав вследствие протекания следующих обратимых реакций:
СН2O + Н2О ↔ НОСН2ОН
НО(СН2O)nН + НОСН2ОН ↔ НО(СН2O)n+1Н + Н2O
НО(СН2O)nН + СН3ОН ↔ СН3O(СН2O)nН + Н2O
В реакции с фенолом участвует наиболее реакционноспособный свободный формальдегид, концентрация которого в растворе мала. По мере расходования формальдегида происходит смещение равновесия влево. При этом скорость образования формальдегида выше скорости его расходования на реакцию с фенолом. Поэтому в процессе взаимодействия фенола с формальдегидом стадии дегидратаций метиленгликоля, деполимеризации олигооксиметиленгликолей и разложения полуацеталей не являются лимитирующими.
Получение и некоторые свойства.
Резольные смолы:
Впромышленности резольные олигомеры получают поликонденсацией фенола с избытком формальдегида в присутствии щелочных катализаторов. Мольное соотношение фенол: формальдегид для различных марок резолов колеблется в широких пределах и составляет 1:1,1—2,1. В качестве катализаторов применяют гидроксид бария, аммиачную воду и едкий натр в количестве 1,2— 2 масс. ч. на 100 масс. ч. фенола.
Взависимости от назначения резольные олигомеры можно получать жидкими и практически безводными или твердыми (так называемые сухие резолы). Преимуществом твердых резолов по сравнению с жидкими являются относительная стабильность их свойств в процессе хранения,
8

меньшее содержание свободного фенола, более высокие диэлектрические показатели и химическая стойкость. От твердых новолаков они отличаются более низкой температурой плавления и относительно высоким содержанием свободного фенола. Твердые резолы содержат обычно 8—12% свободного фенола, жидкие — 20% и выше. Кроме того, выпускают резолы для лаков, эмульсионные олигомеры и фенолоспирты— водорастворимые начальные продукты конденсации.
Резольные олигомеры представляют собой твердые или жидкие продукты, способные при нагревании или при комнатных температурах особенно в присутствии кислот превращаться в полимеры пространственной структуры. Продолжительность отверждения уменьшается с повышением температуры и
вприсутствии орто-ориентирующих катализаторов, так как скорость, процессов конденсации гидроксиметильных групп по свободным пара-положениям выше, чем по орто-положениям. Растворимость олигомеров зависит от молекулярной массы: начальные продукты поликонденсации, включая двух- и трехъядерные соединения, растворяются
вводе, более высокомолекулярные продукты (со степенью поликонденсации Р>5) хорошо растворяются в спиртах и кетонах. Полимеры полностью утрачивают растворимость. Цвет олигомеров и полимеров меняется в зависимости от использованного катализатора: от светло-желтого в случае аммиака и аминов до темно-коричневого при поликонденсации в присутствии щелочи. В зависимости от способа получения свойства резолов меняются в довольно широких пределах, в то время как свойства новолаков разных марок мало различаются между собой. Резольные полимеры (отвержденные олигомеры — резиты) обладают более высокими диэлектрическими показателями, водостойкостью и химической стойкостью, чем новолачные полимеры после отверждения гексаметилентетрамином. Резиты в чистом виде используются крайне редко, поскольку высокие внутренние напряжения, возникающие при их отверждении, приводят к
9
растрескиванию изделий в процессе эксплуатации. Кроме того, свойства и их внешний вид (окраска) быстро меняются. [5]
Синтез фенолформальдегидной смолы в щелочной среде в лаборатории, которым мы пользовались:
В круглодонную колбу емкостью 250 мл, снабженную обратным холодильником и мешалкой, вносят 12,5 г фенола, 6,3 мл воды и 0,4 г NaOH. Содержимое колбы осторожно перемешивают до полного растворения фенола и щелочи. Затем в колбу добавляют 24 мл 40%-ого раствора формалина и нагревают на песчаной бане до начала кипения реакционной смеси. Раствор кипятят 10-15 минут, затем охлаждают до 50°С, вводят приготовленный насыщенный раствор NaOH в 5 мл формалина, снова нагревают до кипения и кипятят 1-2 мин. Полученную смолу выливают на лист жести и охлаждают. Смола имеет светло-коричневый цвет. [1]
Рассмотрим реакции, протекающие при этих процессах.
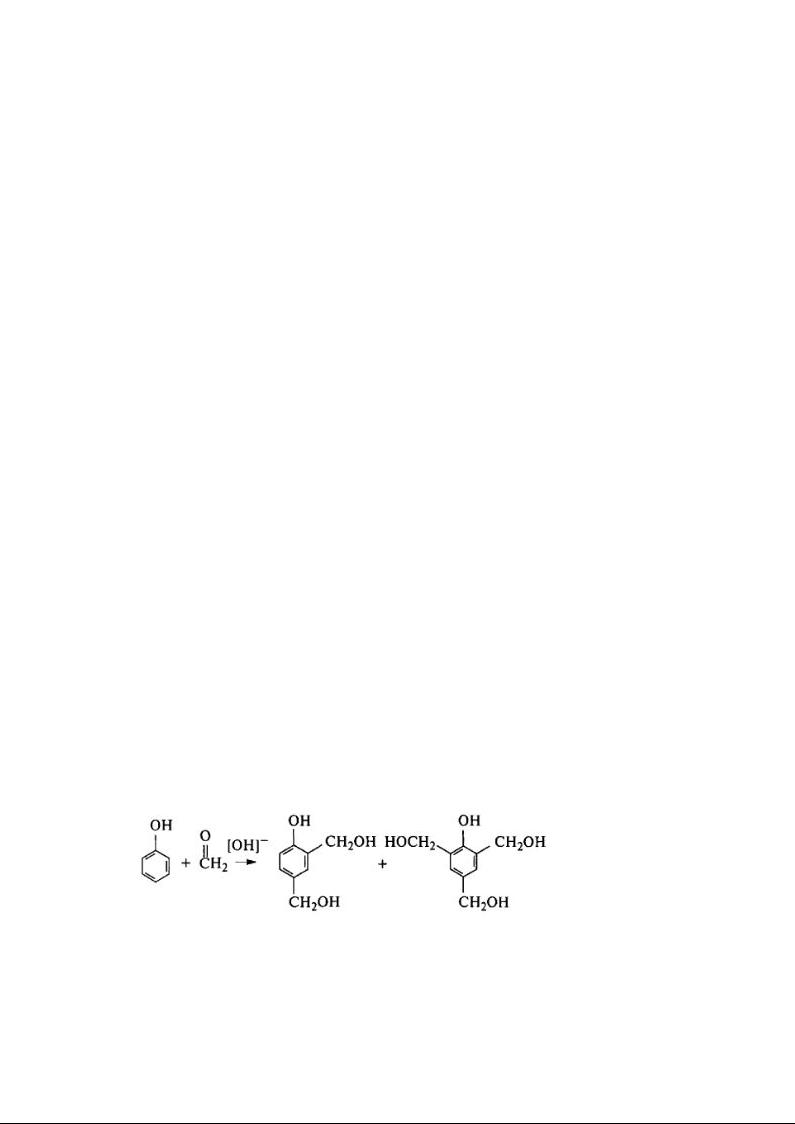
Реакция получения фенолформальдегидной смолы. При взаимодействии фенола с избытком формальдегида (6:7) в щелочной среде происходит реакция замещения водородных атомов, находящихся в орто- и параположениях к гидроксильной группе, на метилольные группы. Одновременно получаются ди- и триметилольные производные фенола:
10
